La administración de fluidos es esencial para la supervivencia del paciente critico en shock, independientemente de la causa que lo origine.
Este aporte ocurre en mayor cuantía durante las primeras horas y días de estancia, dado que durante las mismas es cuando se lleva a cabo la reanimación del paciente que con frecuencia ingresa en UCI por shock o hipotensión de cualquier etiología.
La fluidoterapia es una técnica desafiante, ya que no existe fórmula que funcione por igual en todos los pacientes, si no que requiere una cuidadosa evaluación que permita conocer las necesidades individuales en cada caso.
Las dos primeras preguntas que se plantea cualquier profesional ante la terapia de fluidos es:
¿Qué fluido aportar?
¿Cuánto fluido administrar y en cuánto tiempo?
Para responder a estas preguntas la primera distinción que hay que plantear es si el paciente precisa fluidos de mantenimiento o reemplazo de fluidos.
Fluidoterapia de mantenimiento
La fluidoterapia de mantenimiento está indicada para pacientes que o no pueden beber lo suficiente o directamente no pueden ingerir ningún tipo de líquido, pero a pesar de ello no tienen disminución de volumen, hipotensión o pérdidas continuas.
Además, la perdida se produce por causas fisiológicas como la orina, el sudor o las vías respiratorias.
Fluidoterapia de reemplazo
Los líquidos de reemplazo están destinados a reemplazar los líquidos y electrolitos corporales cuyas pérdidas no son únicamente fisiológicas si no que se incluyen vómitos, diarrea o quemaduras cutáneas graves.
Al diseñar una estrategia de administración de fluidos es preciso considerar estas 2 categorías como punto de partida.
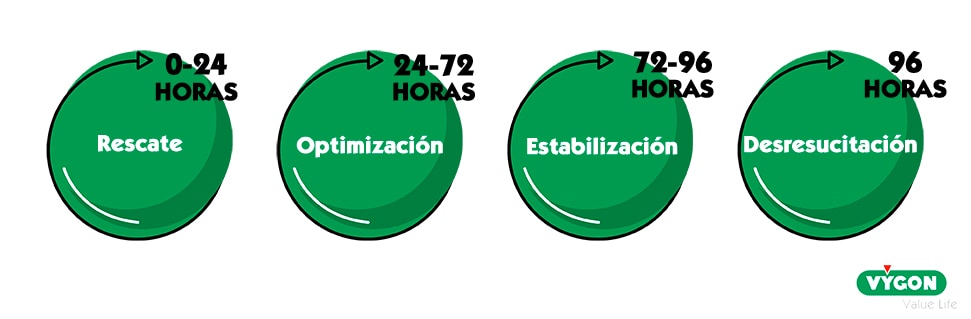
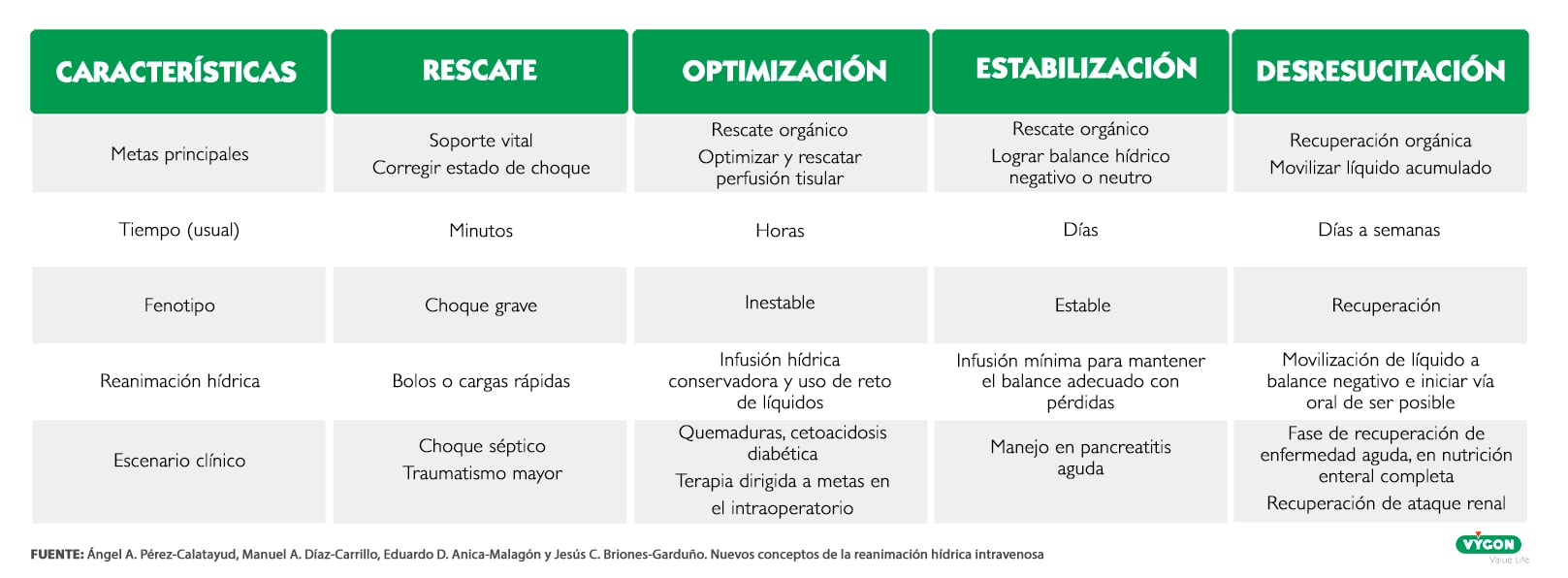
La reanimación cuenta con cuatro fases, que lógicamente van ligadas a las diferentes fases clínicas que encontramos en la terapia de fluidos durante el transcurso de tiempo que dura el tratamiento y en el cual los pacientes experimentan una mejoría en su estado.
Para exponer estas cuatro fases de la reanimación vamos a centrarnos en uno de los escenarios clínicos más comunes y complejos a los que se enfrentan los profesionales: el paciente con sock séptico.
Este paciente se caracteriza por una primera etapa donde muestra un shock hiperdinámico con una resistencia vascular sistémica disminuida debido a la vasodilatación, una mayor permeabilidad capilar y una hipovolemia intravascular absoluta o relativa grave.
Las 4 fases de la reanimación hídrica intravenosa son:
Rescate
Esta fase está caracterizada por una fuerte vasodilatación que conduce a una presión arterial media baja y un deterioro microcirculatorio.
También puede ir acompañado de un alto o bajo gasto cardiaco, en el caso de un shock séptico el gasto cardiaco será bajo y vendrá acompañado de una hipovolemia severa o una cardiomiopatía inducida por sepsis.
Esta fase abarca desde los primeros minutos de la terapia de fluidos hasta las 24 horas y se caracteriza por una estrategia de fluidos dirigida por objetivos basada en una rehidratación temprana para la estabilización de la hipoperfusión tisular.
Es importante infundir una cantidad de líquido individualizado para cada paciente. Mediante la utilización de monitores hemodinámicos será posible evaluar la necesidad de líquidos y las condiciones premórbidas del paciente.
En esta fase, la administración de líquidos aumentará significativamente el gasto cardíaco en la mayor parte de los casos. Sin embargo, después de los primeros bolos de líquido, la probabilidad de falta de respuesta es alta. Debe tenerse en cuenta que la respuesta solo se puede determinar a tras la administración del bolo y siempre que se utilice un dispositivo de monitorización que nos permita calcular el gasto cardíaco.
¿Qué fluido aportar y cuánto?
En la “Campaña Sobrevivir a la Sepsis” encontramos recomendaciones para la terapia de fluidos en pacientes con sepsis:
- El choque septicémico y la sepsis son emergencias médicas y es recomendable iniciar el tratamiento y la reanimación de forma inmediata.
- La primera opción de terapia en pacientes con sepsis será la administración de al menos 30ml/kg de cristaloides intravenosos dentro de las primeras 3 horas.
- Valoraciones hemodinámicas, como la evaluación de la función cardiaca, para determinar el tipo de shock.
- Utilización de variables dinámicas en lugar de estáticas para predecir la respuesta a la administración de líquidos.
- Presión arterial media objetivo de 65 mm Hg en pacientes con choque septicémico que requieran vasopresores.
- Normalizar el lactato cuando esté elevado, por ser un marcador de hipoperfusión tisular.
Durante la reanimación debe realizarse una observación constante de la situación hemodinámica del paciente para evitar un tratamiento excesivo o insuficiente.
Optimización
Una vez se han administrado los bolos y el profesional determina que el paciente ha sido “rescatado” comenzara la fase de optimización. Que abarca desde las 24h tras comenzar con la fluidoterapia hasta las 72 h.
El objetivo en esta fase es tratar de reducir la hipovolemia, asegurando un correcto suministro de oxígeno a los órganos en riesgo y, por consiguiente, prevenir un fallo orgánico debido a la hipoperfusión o edema tisular.
La acumulación de líquido determinará la gravedad de la enfermedad, considerándose un marcador de esta.
Cuanto mayor sea la necesidad de líquidos, más grave será la enfermedad y más probable será un fallo orgánico.
¿Qué fluido aportar y cuánto?
Obviamente es necesario tener en cuenta el contexto clínico, la cantidad a administrar debe estar relacionada con la causa que ha provocado el shock séptico.
Pruebas para predecir la respuesta a fluidos
Al encontrarnos una reducción en el índice de hipovolemia la cantidad de fluido necesaria también será menor, encontrándose normalmente entre los 5 y 15 ml/kg.
Para poder determinar la cantidad exacta de líquido a administrar es importante tratar de predecir la respuesta a fluidos, para ello podemos servirnos de dos técnicas:
-
Test de elevación pasiva de piernas (TEPP)
Para realizarlo se parte de una posición semirreclinada y se pasa a una posición donde las piernas se levantan 45° y el tronco se mantiene horizontal.
La transferencia de sangre venosa desde las extremidades inferiores y el compartimento esplácnico hacia las cavidades cardíacas imita el aumento de la precarga inducida por la infusión de líquidos.

-
Test de oclusión al final de la espiración (TOFE)
Consiste en detener la ventilación mecánica al final de la espiración durante 15 segundos y medir los cambios resultantes en el gasto cardíaco.
Un aumento en el gasto cardíaco por encima del umbral del 5% indica precarga / capacidad de respuesta de fluidos.
En esta fase también puede que el profesional tome la decisión de abstenerse de administrar líquidos basándose en índices que indiquen el riesgo de una posible sobrecarga de líquidos.
Indicadores de riesgo de sobrecarga de líquidos
Insuficiencia pulmonar
La insuficiencia pulmonar es uno de los escenarios donde peores consecuencias podemos encontrar debido a una sobrecarga de líquidos.
Para estimar el riesgo pulmonar por una alta infusión de líquidos debemos conocer:
- El índice de agua pulmonar extravascular(EVLWI)
- El índice de permeabilidad vascular pulmonar: se trata de uno de los factores clave para determinar un edema pulmonar.
Hipertensión intraabdominal
La hipertensión intraabdominal es otra de las consecuencias más comunes de una excesiva administración de fluidos.
La presión intraabdominal debe controlarse con precaución, principalmente en pacientes de riesgo.
Estabilización
Tras 72h desde el inicio de la fluidoterapia comienza la fase de estabilización, la cual se puede extender hasta las 96h desde el momento de comienzo del tratamiento.
Llegados a este punto, el paciente ya está estable y el objetivo será la prevención del daño a los órganos diana.
La estabilización se caracteriza por una terapia hídrica de mantenimiento, donde se busca que el balance hídrico acumulado sea neutro o negativo, ya que un balance positivo mantenido en el tiempo se asocia con una mayor tasa de mortalidad en los pacientes sépticos.
¿Qué fluido aportar y cuánto?
La fluidoterapia de mantenimiento solamente se utilizará con el fin de cubrir las necesidades diarias de líquidos y electrolitos.
Si el paciente recibe ingestas diarias mediante otras vías como puede ser la nutrición enteral o parenteral se suspenderá la terapia intravenosa de líquidos.
Desresucitación
Ya se ha logrado la estabilidad hemodinámica o bien han pasada 96h desde que comenzó el tratamiento.
En esta fase se busca conseguir un balance hídrico negativo restringiendo la administración de líquidos intravenosos o induciendo una diuresis espontanea para restaurar la función hemodinámica intrínseca.
La fluidoterapia puede salvar muchas vidas, no obstante, al tratarse de un tratamiento de alta complejidad requiere un conocimiento exhaustivo de la relación dosis-efecto, así como, de los efectos secundarios de cada de fluido, para poder personalizar el tratamiento a cada paciente durante las cuatro fases del tratamiento.
[accordion title=’Bibliografia’]
Bibliografía:
[1] Teboul JL, Monnet X. “etección de la capacidad de respuesta al volumen y la falta de respuesta en pacientes de la unidad de cuidados intensivos: dos problemas diferentes, una sola solución. Cuidado crítico. 2009; 13 (4): 175. doi: 10.1186 / cc7979.
[2] Bagshaw SM, Brophy PD, Cruz D, Ronco C. Balance de fluidos como biomarcador: impacto de la sobrecarga de fluidos en el resultado en pacientes críticos con lesión renal aguda. Cuidado crítico. 2008; 12 (4): 169. doi: 10.1186 / cc6948.
[3] Malbrain MLNG, Van Regenmortel N, Saugel B, et al. Principles of fluid management and stewardship in septic shock: it is time to consider the four D’s and the four phases of fluid therapy. Ann Intensive Care. 2018;8(1):66. Published 2018 May 22. doi:10.1186/s13613-018-0402-x
[4] Weil MH, Henning RJ. New concepts in the diagnosis and fluid treatment of circulatory shock. Thirteenth annual Becton, Dickinson and Company Oscar Schwidetsky Memorial Lecture. Anesth Analg. 1979;58(2):124–132. doi: 10.1213/00000539-197903000-00013.
[5] Monnet X, Teboul JL. Passive leg raising: five rules, not a drop of fluid! Crit Care. 2015;19:18. doi: 10.1186/s13054-014-0708-5.
[6] Jozwiak M, Depret F, Teboul JL, Alphonsine JE, Lai C, Richard C, Monnet X. Predicting fluid responsiveness in critically ill patients by using combined end-expiratory and end-inspiratory occlusions with echocardiography. Crit Care Med. 2017;45(11):e1131–e1138. doi: 10.1097/CCM.0000000000002704.
[7] Hoste EA, Maitland K, Brudney CS, et al. Four phases of intravenous fluid therapy: a conceptual model. Br J Anaesth. 2014;113(5):740–747. doi:10.1093/bja/aeu300
[8] Rivers E, Nguyen B, Havstad S, Ressler J, Muzzin A, Knoblich B, Peterson E, Tomlanovich M. Terapia temprana dirigida a objetivos en el tratamiento de sepsis severa y shock séptico. N Engl J Med. 2001; 345 (19): 1368-1377. doi: 10.1056 / NEJMoa010307.
[9] Ángel A. Pérez-Calatayud, Manuel A. Díaz-Carrillo, Eduardo D. Anica-Malagón y Jesús C. Briones-Garduño. Nuevos conceptos de la reanimación hídrica intravenosa[/accordion]
Si quieres saber más acerca de fluidoterapia, rellena el formulario con tus datos y dudas e intentaremos ayudarte a resolverlas.
Tranquil@, esto NO es una lista de SPAM. SOLO utilizaremos tus datos para responder a las preguntas que nos hagas.


0 comentarios
Trackbacks/Pingbacks