La elastancia arterial es una característica física de los vasos arteriales que se ha investigado recientemente en numerosos estudios científicos con el fin de identificar su posible interpretación y correlación en el contexto de la monitorización hemodinámica avanzada en pacientes críticos para mejorar aún más la gestión de fluidos y la administración de terapias dirigidas.
Estos estudios han sido posibles gracias a que en los nuevos sistemas de monitorización hemodinámica es posible identificar el valor de la elastancia arterial de forma mínimamente invasiva y precisa.
En el siguiente artículo, recordaremos algunos principios de la fisiología del sistema cardiovascular, para poder presentar con mayor claridad los hallazgos recientes sobre este innovador parámetro hemodinámico.
- Definición de la «elastancia arterial»
- Los componentes de los cuales depende
- Las fórmulas para calcularla
- Su posición en el diagrama presión-volumen del ventrículo izquierdo
- Revisión bibliográfica de su utilidad para mejorar la hemodinámica del paciente
¿Qué es la elastancia arterial?
El Sistema Cardiovascular está formado por el corazón y los vasos sanguíneos y su función es garantizar que la sangre, rica en oxígeno y nutrientes, llegue a todas las células y tejidos. Un aspecto crucial de este sistema es la elastancia arterial, que desempeña un papel clave en la regulación de la presión arterial y la salud general del sistema cardiovascular.
La elastancia arterial se refiere a la capacidad de un vaso arterial para dilatarse y volver a su forma original tras ser sometido a una deformación.
Cuando el corazón bombea sangre a las arterias durante la sístole, éstas sufren una relajación. La elastancia permite a las paredes arteriales adaptarse a esta presión, dilatándose durante la sístole y volviendo a su forma original durante la diástole. Esta característica es esencial para mantener una presión arterial y un flujo sanguíneo constantes y evitar daños en los vasos sanguíneos.
¿De qué depende?
Los principales componentes de la pared arterial que determinan la elastina arterial y su comportamiento no lineal son la elastina, el colágeno y las células musculares lisas (CML). La distribución de estos componentes difiere notablemente entre las arterias centrales elásticas y las arterias musculares periféricas: en las arterias elásticas, la elastina es el componente dominante, mientras que las arterias musculares están formadas principalmente por colágeno y tejido muscular liso.
Debido a las propiedades elásticas de las grandes arterias, parte de la energía de la contracción ventricular se almacena en la pared arterial en forma de energía potencial durante la sístole y luego se libera como energía cinética durante la diástole. Cuanto más rígida es la pared de las arterias, menos energía potencial se almacena en ellas durante la contracción ventricular y la eyección de la sangre.
Por lo tanto, la presión en sístole aumenta debido a la incapacidad de convertir la energía cinética en energía potencial durante la eyección, y la presión diastólica disminuye debido a la falta de energía potencial disponible para volver a convertirse en energía cinética durante la diástole.
¿Cómo se calcula?
Para describir la capacidad de la carga elástica de modificar su volumen a medida que cambia la presión interna, se suele utilizar la compliance, una magnitud definida como la relación entre el cambio de volumen y el cambio de presión que lo ha generado. Según esta determinación, la compliance es la cantidad inversa a la elastancia y es una medida de la distensibilidad elástica del vaso.
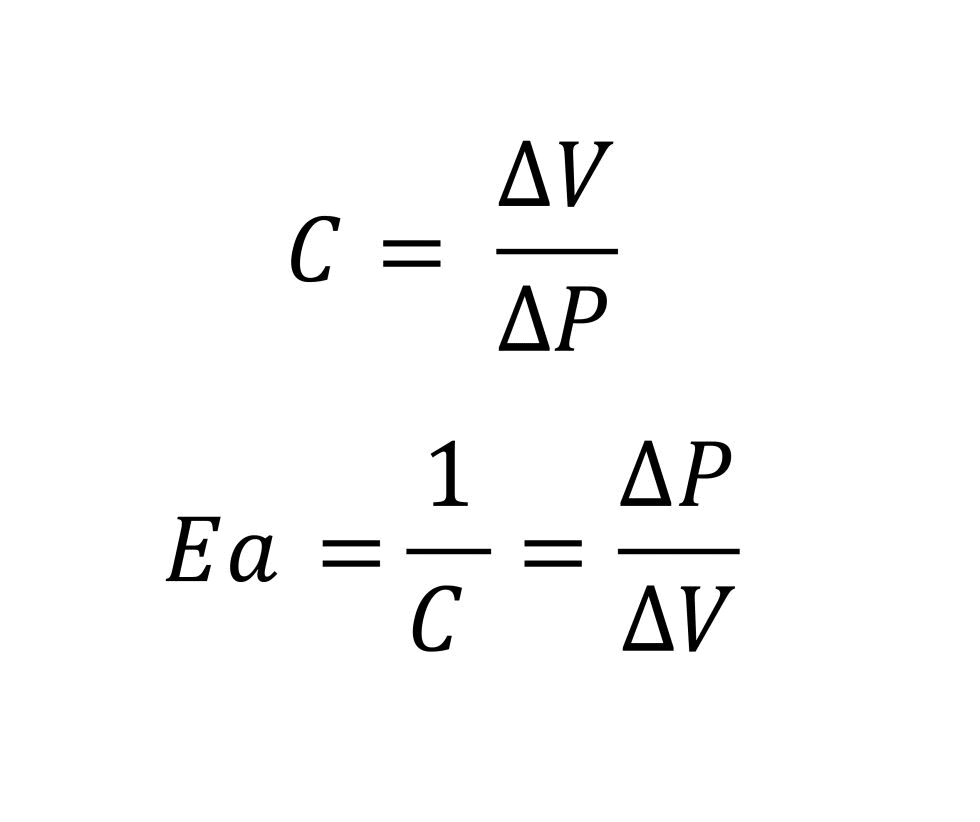
Así pues, la elastancia arterial puede determinarse fisiológicamente por la relación entre la presión de fin de sístole y el volumen sistólico. La presión de fin de sístole corresponde a la presión a la que se cierra la válvula aórtica, también llamada presión dicrótica.
La elastancia arterial es, por tanto, uno de los componentes de la denominada poscarga a la que se enfrenta el ventrículo izquierdo durante la sístole y, por tanto, la eyección del volumen sistólico.
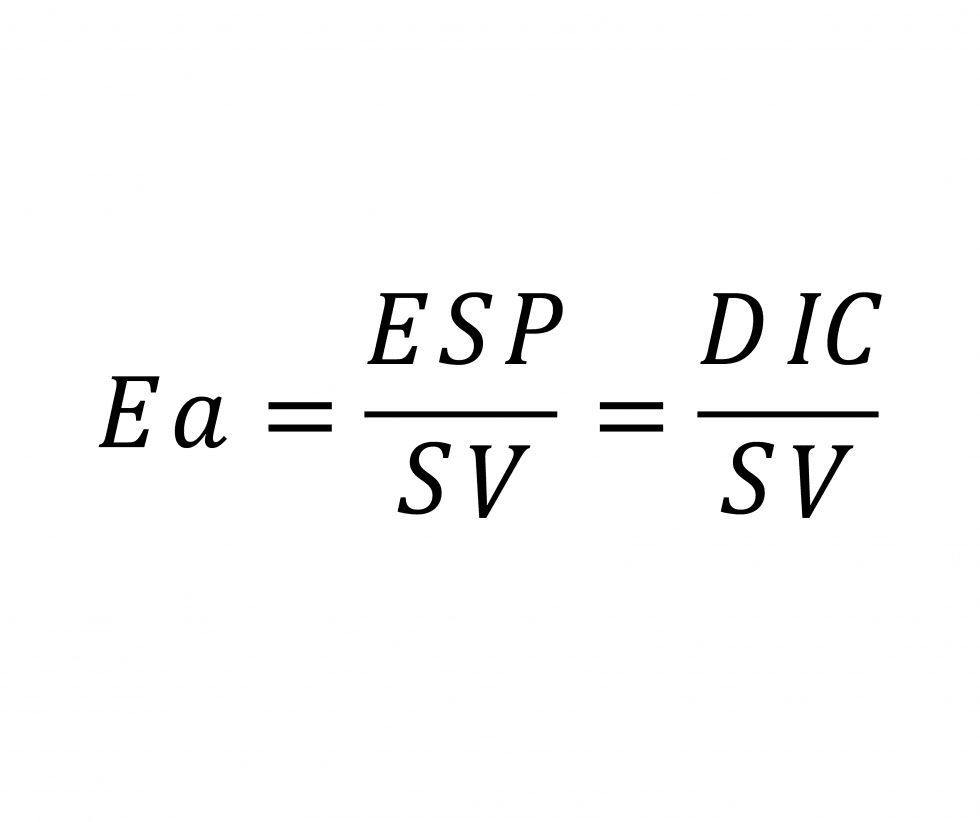
¿Cómo se sitúa el gráfico de elastancia arterial dentro del diagrama presión-volumen del ventrículo izquierdo?
Repasemos brevemente el diagrama presión-volumen.
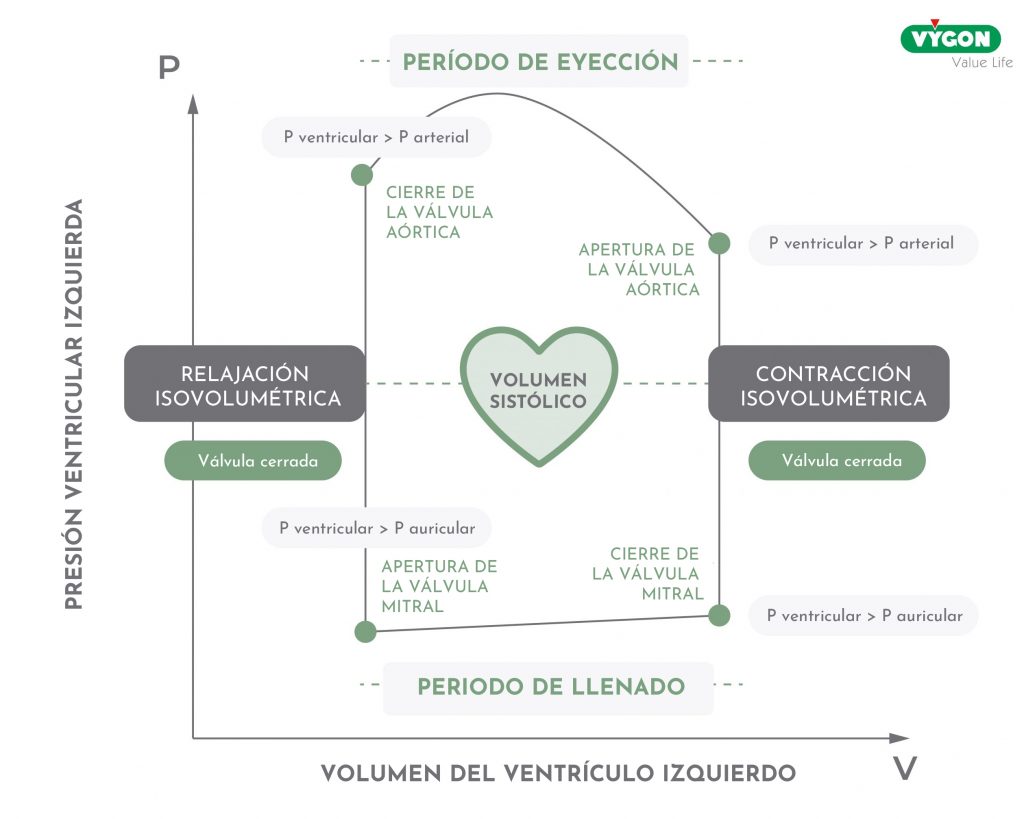
A partir del punto donde la válvula mitral se cierra y luego el punto al final de la diástole, la contracción comienza aquí, la presión comienza a aumentar, pero hasta que es menor que la presión aórtica la válvula aórtica está cerrada. Ambas válvulas están cerradas, el volumen es constante, por eso esta fase se llama contracción isovolumétrica.
Cuando la presión se hace mayor que la presión aórtica y la válvula aórtica se abre, comienza la fase de expulsión de la sangre del ventrículo izquierdo, denominada periodo de eyección. Al final de esta fase, la presión vuelve a ser inferior a la presión aórtica y la válvula se cierra. Se produce entonces la relajación isovolumétrica, la presión sigue bajando pero las válvulas están cerradas y el volumen es constante. Cuando la presión cae por debajo de la presión auricular y la válvula mitral se abre, se inicia el llenado diastólico: la sangre pasa de la aurícula izquierda al ventrículo izquierdo. La contracción auricular completa el llenado ventricular.
Retomando la fórmula de la elastancia
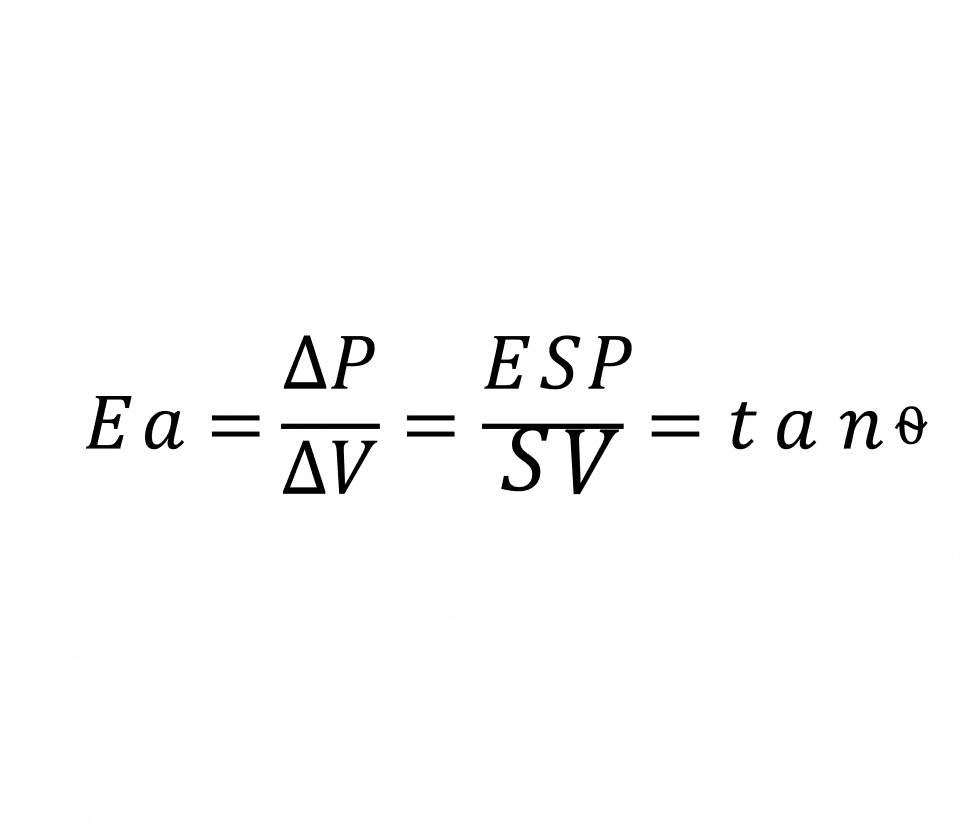
Su visualización gráfica en el diagrama presión-volumen del ventrículo izquierdo es la siguiente:
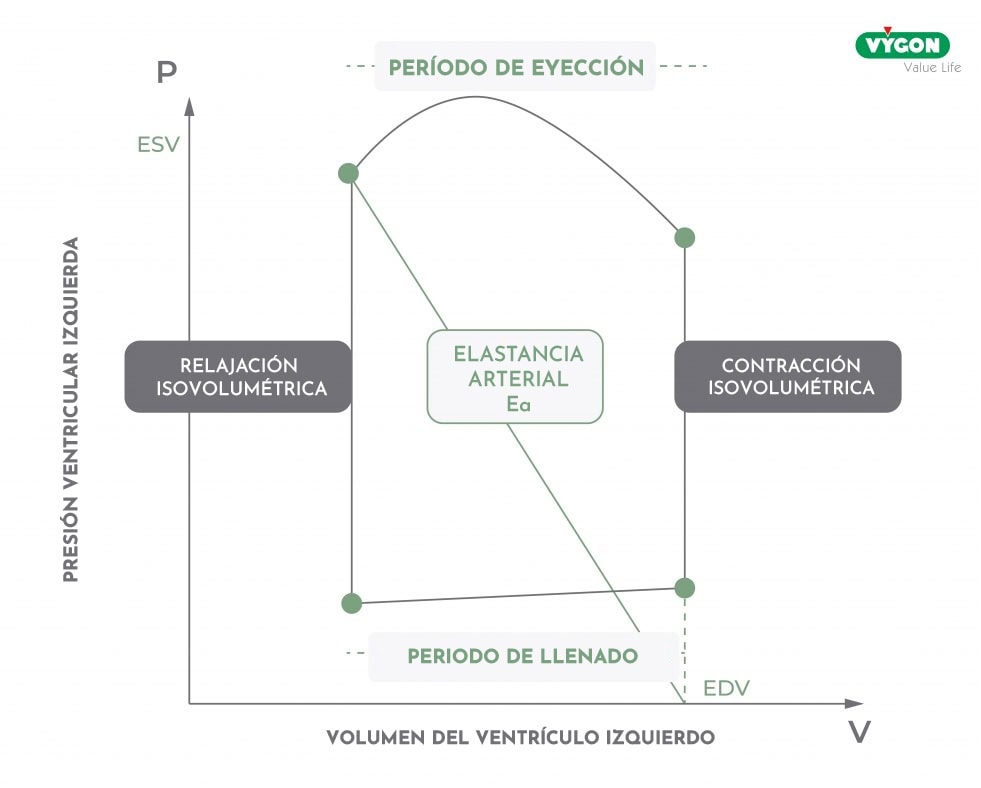
¿Es posible utilizar la elastancia arterial como parámetro para mejorar la gestión hemodinámica del paciente?
Hay una serie de estudios recientes que incluyen el parámetro de la elastancia arterial en las consideraciones sobre el estado hemodinámico del paciente y, especialmente, sobre su respuesta a determinadas decisiones terapéuticas. Estos estudios han sido posibles gracias a que en los nuevos sistemas de monitorización hemodinámica es posible identificar el valor de la presión de fin de sístole, definida como presión dicrótica, a partir del análisis de la curva de presión arterial, y sobre todo es posible conocer de forma fiable el valor del volumen sistólico en cada latido mediante el cálculo de la impedancia cardiovascular del paciente. Por lo tanto, para cada latido se dispone del valor de la elastancia arterial.
ESTUDIO 1: REDUCCIÓN DE ELASTANCIA TRAS ADMINISTRACIÓN DE FLUIDOS
En el estudio Bond et. 2019, por ejemplo, se demostró una reducción significativa de la elastancia arterial después de administrar al paciente una carga de fluidos. La administración de fluidos es una de las intervenciones terapéuticas más utilizadas para aumentar la presión arterial y el gasto cardíaco en presencia de sospecha de hipovolemia. Sin embargo, en pacientes en shock séptico, en presencia de una vasodilatación importante, es posible que la presión arterial no aumente aunque aumente el gasto cardíaco, por lo que los pacientes responden a la administración de fluidos. La disminución de la elastancia arterial tras la administración de fluidos también concuerda con otros estudios y respalda el valor de la elastancia arterial como índice de la capacidad de respuesta a los fluidos en pacientes críticos.
ESTUDIO 2: EFECTOS DE LA REDUCCIÓN DE LA FRECUENCIA CARDIACA SOBRE ELASTANCIA ARTERIAL
En el estudio de Morelli et al. 2016, se estudiaron los efectos de la reducción de la frecuencia cardiaca sobre la elastancia arterial en pacientes con shock séptico. Con el fármaco betabloqueante Esmolol, se redujo la frecuencia cardiaca que inicialmente estaba por encima de 95 lpm y se produjo una reducción de la elastancia arterial y un aumento paralelo del volumen sistólico en todos los pacientes. Aunque el gasto cardíaco y la fracción de eyección permanecieron inalterados, se redujeron las necesidades de norepinefrina. La elastancia arterial es de hecho un determinante importante del acoplamiento ventricular arterial, y su reducción puede ayudar a mejorar la eficiencia cardiovascular y asegurar una perfusión sistémica adecuada en pacientes con shock séptico grave.
El desacoplamiento ventricular arterial se asocia a una ineficacia cardiovascular y a una energía miocárdica desfavorable, que pueden empeorar progresivamente a lo largo de la enfermedad. La taquicardia también aumenta el consumo miocárdico de oxígeno y, al acortar el tiempo de relajación diastólica, puede deteriorar la perfusión coronaria. Todos estos efectos pueden contribuir aún más a la disfunción miocárdica y a un pronóstico cada vez peor. Dado que la Ea viene determinada linealmente por el volumen sistólico, cualquier mejora del tiempo diastólico y del llenado diastólico (a través de una disminución de la frecuencia cardíaca) puede afectar directamente a la elastancia arterial.
ESTUDIO 3: CORRELACIÓN ELASTANCIA ARTERIAL Y RESPUESTA ADMINISTRACIÓN DE FLUIDOS
En el estudio de Messina et al. 2017 volvemos a encontrar una correlación entre la elastancia arterial y la respuesta a la administración de fluidos en pacientes con shock séptico. También en este estudio se demostró cómo la elastancia arterial se reducía significativamente en los pacientes que de hecho respondían a los fluidos, frente a los que no, y cómo en estos pacientes no es posible basarse en cambio en los valores de VPP, normalmente utilizados como índice de la capacidad de respuesta a los fluidos.
Conclusiones
Así pues, la elastancia arterial se perfila como un indicador valioso para mejorar la gestión hemodinámica de los pacientes críticos. De hecho, este parámetro abre nuevas perspectivas en la evaluación de la dinámica cardiovascular, sugiriendo enfoques terapéuticos más personalizados. La integración consciente de este parámetro en la práctica clínica puede ayudar a optimizar la eficiencia cardiovascular, garantizando un tratamiento más específico y eficaz de los pacientes.
Sigue aprendiendo sobre monitorización hemodinámica con las Píldoras de Conocimiento de VYHEMDAYS:
Píldoras de conocimiento VYHEMDAYS
Bibliografía
Nichols WW, Edwards DG. Arterial elastance and wave reflection augmentation of systolic blood pressure: deleterious effects and implications for therapy. J Cardiovasc Pharmacol Ther. 2001 Jan;6(1):5-21. doi: 10.1177/107424840100600102. PMID: 11452332.
Chirinos JA. Arterial stiffness: basic concepts and measurement techniques. J Cardiovasc Transl Res. 2012 Jun;5(3):243-55. doi: 10.1007/s12265-012-9359-6. Epub 2012 Mar 24. PMID: 22447229.
Bond O, De Santis P, Iesu E, Franchi F, Vincent JL, Creteur J, Taccone FS, Scolletta S. Relationship between Microcirculatory Perfusion and Arterial Elastance: A Pilot Study. Crit Care Res Pract 2019 Mar 26;2019:3256313.
Morelli A, Singer M, Ranieri VM, D’Egidio A, Mascia L, Orecchioni A, Piscioneri F, Guarracino F, Greco E, Peruzzi M, Biondi-Zoccai G, Frati G, Romano SM. Heart rate reduction with esmolol is associated with improved arterial elastance in patients with septic shock: a prospective observational study. Intensive Care Med 2016.
Messina A, Romano SM, Bonicolini E, Colombo D, Cammarota G, Chiostri M, Della Corte F, Navalesi P, Payen D, Romagnoli S. Cardiac cycle efficiency and dicrotic pressure variations: new parameters for fluid therapy: A pilot observational study. Eur J Anaesthesiol 2017; 34:1–9.
Guarracino F, Bertini P, Pinsky MR. Cardiovascular determinants of resuscitation from sepsis and septic shock. Crit Care 2019 Apr 15;23(1):118.





0 comentarios
Trackbacks/Pingbacks