El 32% de los catéteres intravenosos periféricos (PIVC) y el 36 % de los catéteres venosos centrales (CVC) sufren oclusiones, lo que provoca retrasos en el tratamiento, aumento del riesgo de infección, fallo del catéter y, como consecuencia, reemplazo del dispositivo.
Un mantenimiento y desinfección adecuada de los dispositivos intravenosos y, en concreto, del conector sin aguja, nos ayudará a reducir estas problemáticas.
¿QUÉ ENCONTRARÁS EN ESTE ARTÍCULO?
- Tipos de conectores sin aguja
- ¿Cómo evitar la infección?
- ¿Qué dicen las guías con respecto al conector sin aguja?
- Limpieza del acceso al conector sin aguja
- Secado
- Lavado pulsátil
- Secuencia de clampado
- Reemplazo
¿Quieres saber más sobre el mantenimiento y desinfección de los conectores sin aguja? Permanece en esta página y lee la entrada completa.
El mayor riesgo de contaminación del catéter después de la inserción se produce a través del conector de acceso con una tasa de 33-45%. Empleando un procedimiento de desinfección adecuado se reduce a un 10%.1
Tipos de conectores sin aguja
Los conectores sin aguja son dispositivos que se conectan al extremo de los catéteres y permiten el acceso a este para la infusión o extracción.
Podemos clasificar los conectores sin aguja según:
- Mecanismo interno: válvula mecánica o Split Septum.
- Desplazamiento del fluido: positivo, negativo, neutro o antirreflujo.
¿Cómo evitar la infección?
El 32% de los catéteres intravenosos periféricos (PIVC) y el 36 % de los catéteres venosos centrales (CVC) sufren oclusiones, lo que provoca retrasos en el tratamiento, aumento del riesgo de infección, fallo del catéter y, como consecuencia, reemplazo del dispositivo.4
Una de las herramientas que ha permitido reducir estas complicaciones son los conectores sin aguja.
Te puede interesar
No obstante, no están exentos de riesgos, por lo que requieren de cuidados específicos, tal como indica la Infusion Nurses Society (INS) en su guía sobre terapia de infusión al referirse a los conectores sin aguja:
“Potenciales sitios de contaminación microbiana intraluminal que requieren una cuidadosa adherencia a prácticas de prevención de infecciones.”5
Una buena práctica y mantenimiento de la vía, así como una selección adecuada del conector sin aguja, permitirá reducir notablemente la probabilidad de que se produzca la infección.
¿Qué dicen las guías con respecto al tipo de conector sin aguja?
Guías como el proyecto Flebitis Zero o la CDC recogen algunas recomendaciones que pueden ayudarnos a reducir la probabilidad de infección, entre las que se incluyen:
- Canal de paso recto que permita un flujo laminar y sin restricciones.2
- Sin mecanismos internos. 2
- Sin recovecos donde puedan permanecer restos de sangre, gérmenes o precipitados. 2
- Membrana de acceso lisa que permita una desinfección fácil y eficaz. 2
- Split Septum preferible frente a válvulas mecánicas, ya que estas últimas presentan un mayor riesgo de infección.3
Desinfección y mantenimiento adecuado de los conectores sin aguja
Limpieza acceso del conector sin aguja
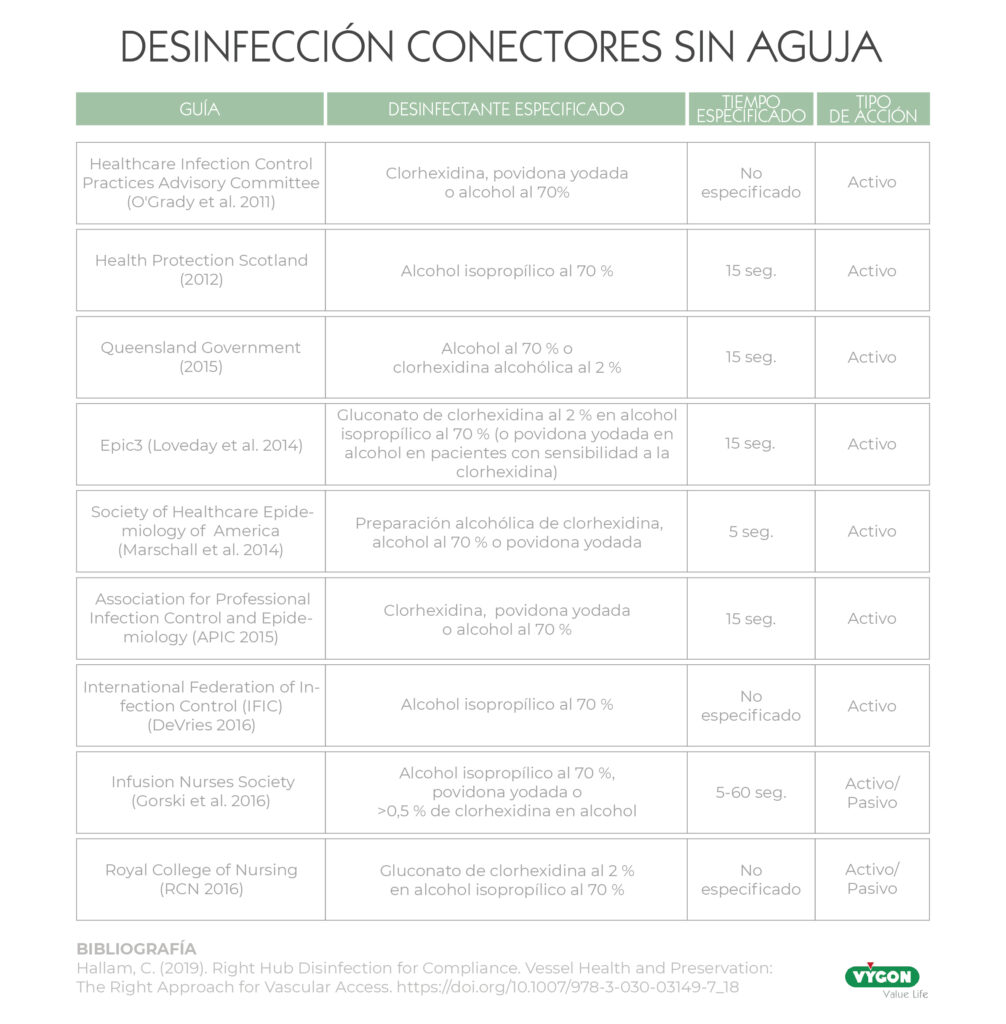
Para limpiar la superficie del conector sin aguja se debe realizar una fricción vigorosa del dispositivo antes de cada acceso con alcohol isopropílico al 70%, povidona-yodo o clorhexidina mayor de 0,5% en solución alcohólica. 9
El tiempo de contacto para la limpieza y el secado depende del diseño del conector y del grado de contaminación. Según las recomendaciones de EPIC3 en 2014 y la INS en 2016, la limpieza debe durar, al menos, 15 segundos. No obstante, existen estudios más recientes que recomiendan que esta limpieza tenga una duración de 30 segundos.8,9
Actualmente, también existen tapones de desinfección pasiva. Estos dispositivos, impregnados en una solución desinfectante, permiten una limpieza del conector sin aguja antes de acceder, actuando como barrera física entre un acceso y otro. Para asegurarnos de que la desinfección ha sido adecuada, deben mantenerse de 1 a 3 minutos, dependiendo del fabricante. 9
Secado
El tiempo de secado dependerá de la limpieza realizada previamente, ya que, por ejemplo, cuando no disponemos de toallitas monodosis y utilizamos una gasa para la desinfección, la cantidad de alcohol o clorhexidina empleada dependerá del operador y, por tanto, el tiempo de secado será variable. 9
Cuando la desinfección se realice de esta forma, el tiempo de secado puede ser de hasta 1 minuto al utilizar soluciones alcohólicas y de más de 2 minutos en el caso de soluciones acuosas. En el caso de toallitas monodosis impregnadas, ya sea de clorhexidina o alcohol al 70%, el tiempo de secado debe indicarlo el fabricante, no obstante, de forma general, se encontrará entre los 15-30 segundos. 9
Con respecto a los tapones de desinfección pasiva, el tiempo de desinfección dependerá del fabricante. Cuando surgieron estos dispositivos, el contacto debía ser de, al menos, 3 minutos. Actualmente, este tiempo se está reduciendo y muchas casas comerciales indican que, tras 1 minuto, ya se consigue una desinfección adecuada. 9
Lavado pulsátil
Un lavado adecuado asegurará un arrastre de todos los residuos presentes en el catéter al final de la infusión. Utilizar dispositivos con canal de paso recto permitirá un flujo laminar y sin restricciones.
La dinámica más utilizada y recomendada para el lavado de los conectores sin aguja es la técnica push stop push. Consiste en realizar un lavado a bolos; con intervalos de 0,4 segundos entre dos bolos, ejerciendo una fuerza constante y uniforme en el interior del catéter. Esta dinámica y el clampado que se realiza antes de desconectar se denomina técnica de lavado de presión positiva. 9
De forma general, cuando administremos soluciones o medicaciones se inyectarán 10 ml de suero fisiológico. En el caso de administrar hemoderivados, contraste, nutrición parenteral, soluciones viscosas o cuando se realicen extracciones será recomendable emplear 20 ml de suero fisiológico en el lavado. 9
Al seleccionar el volumen de lavado, también deberemos tener en cuenta las limitaciones de volumen que presenta cada paciente, para evitar el riesgo de sobrecarga hídrica, especialmente en aquellos pacientes más sensibles a la administración de volumen como son pediátricos, nefrológicos, cardiópatas, etc.9
Otras buenas prácticas que permitirán reducir la infección y obstrucción del catéter son:
- SAS (Salinizar-Administrar-Salinizar): siempre, antes y después de administrar cualquier fármaco, realizar un lavado de la vía. 9
- SASH (Salinizar-Administrar-Salinizar-Heparinizar/Sellar): si se va a dejar el catéter en reposo, será necesario sellar. 9
- ANTT (Aseptic non touch technique/Técnica de no tocar): en caso de no poder asegurar una técnica de no tocar, utilizar técnica estéril para asegurarnos de que la línea no se contamine. 9
Secuencia de clampado
Dependiendo del conector utilizado será preciso realizar una secuencia de clampado específica para evitar el reflujo de sangre y, por tanto, disminuir el riesgo de infección y obstrucción del catéter.

Desplazamiento negativo
Los conectores sin aguja de desplazamiento negativo presentan reflujo de sangre hacia el lumen del catéter al desconectar la jeringa, por ello se debe clampar antes de la desconexión, mediante la técnica de presión positiva.
Desplazamiento positivo
Los conectores sin aguja de desplazamiento positivo mantienen una pequeña cantidad de fluido en el dispositivo; al desconectar el set o la jeringa, este fluido se desplaza hacia el paciente, realizando un lavado de este. Por ello, en este caso, se deberá clampar después de la desconexión de la jeringa.
Desplazamiento neutro
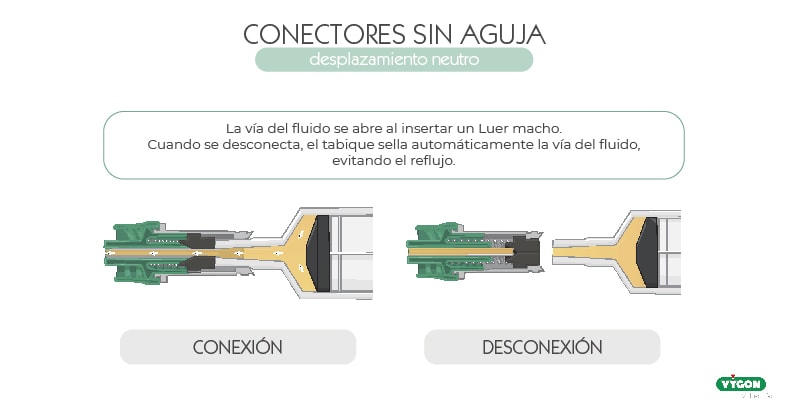
En los conectores sin aguja de desplazamiento neutro, el acceso se realiza a través de la apertura del sello o tabique divisorio, cerrándose automáticamente una vez se retira la jeringa o el equipo de administración de fluidos.
Contiene un mecanismo interno diseñado para evitar el reflujo al conectar o desconectar el equipo de infusión.6 Esto evita, además, tanto el riesgo de obstrucción como de infección.
En principio, no es esencial una secuencia específica de clampado, como ocurre con los conectores de desplazamiento positivo y negativo, debido a que el reflujo es mínimo.
No obstante, todos los conectores de desplazamiento neutro tienen un mínimo reflujo de sangre. Sin embargo, no todos son iguales, tanto es así que, dependiendo de la marca, la tasa de reflujo de los dispositivos de desplazamiento neutro oscila entre 0.12 (±0.15) mm3 y hasta 33.51 (±11.50) mm3.7
Válvulas antirreflujo
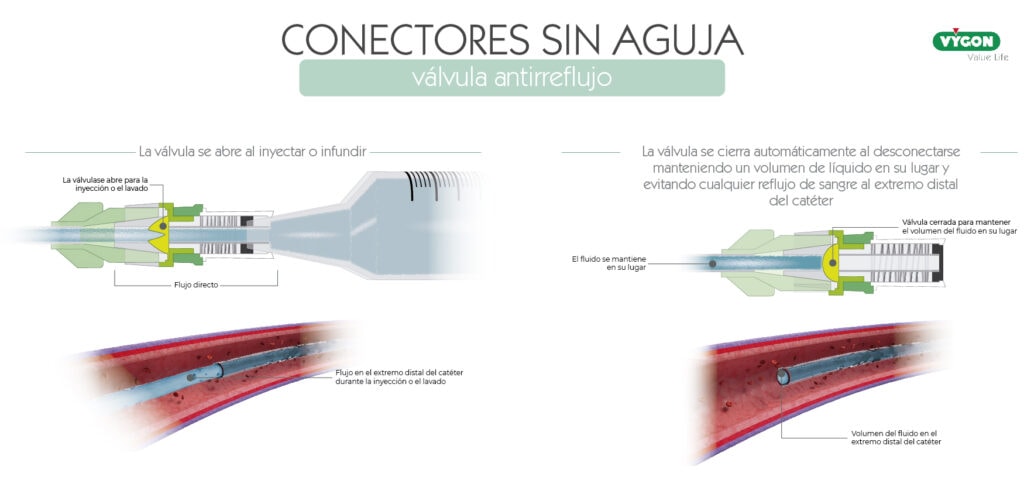
Las válvulas antirreflujo son dispositivos de desplazamiento neutro a los que se les ha añadido una válvula antirreflujo.
Se trata de una válvula de control del fluido bidireccional, la cual permanece cerrada hasta que la fuerza de infusión o extracción alcanza una presión especifica y, a medida que la presión de infusión o extracción empieza a reducirse, la válvula vuelve a cerrarse.
El antirreflujo es el único que tiene un mecanismo interno para evitar la entrada de sangre en el catéter en todas las circunstancias, por lo que, no es necesario clampar, eliminando el riesgo de rotura de la vía tras repetidas secuencias de clampado.
Reemplazo
Los Centers for Disease Control and Prevention (CDC) en la guía de práctica clínica (GPC) de 2011, cuyas recomendaciones se mantienen en la guía del año 2017, indica sobre la prevención de infecciones relacionadas con el catéter intravascular que los sistemas de infusión, entre los que se incluye el conector sin aguja, que deben reemplazarse: 12
- Frecuencia no mayor de 96h., y al menos, cada 7 días de los sistemas de infusión que se usan continuamente, incluidos los conjuntos secundarios y los dispositivos complementarios: pacientes que no reciben sangre, productos sanguíneos o emulsiones de grasa. 12
- Dentro de las 24h. posteriores al inicio de la infusión: sistemas utilizados para administrar sangre, productos sanguíneos o emulsiones grasas (aquellas combinadas con aminoácidos y glucosa en una mezcla 3 en 1 o infundidas por separado). 12
- Cada 6-12h.: sistema utilizado para administrar infusiones de propofol, cuando se cambie el vial, según las recomendaciones del fabricante. 12

Además, deberá reemplazarse de forma inmediata cuando:
- Presenta sangre o desechos. 9
- Antes de extraer una muestra para hemocultivo desde el DAV. 9
- Ante la sospecha de contaminación. 9
- Políticas, procedimientos y/o guías prácticas de la organización. 9
- Cuando lo indique la ficha técnica. 9
Dependiendo del fabricante, la duración puede variar, por ello es importante consultar la ficha técnica y no exceder el tiempo establecido. No obstante, de forma general, los conectores sin aguja y alargaderas deben cambiarse con la misma frecuencia que el conjunto de administración, es decir, de 4 a 7 días. 9
Estas indicaciones están destinadas tanto a los conectores de aguja independientes como a aquellos que van equipados en prolongadores bifurcados o trifurcados, ya que un correcto mantenimiento y cuidado del conector sin aguja mantendrá la vía permeable y reducirá la probabilidad de que se produzca infección u obstrucción.
Delegada especialista en Cuidados Intensivos.
- EXPERIENCIA
Farmacéutica de formación en la mención Clínica y Asistencial, con un Máster en Industria Farmacéutica, tengo tanto experiencia en Oficina de Farmacia, concretamente 7 años, como en la Industria Farmacéutica, 6 años hasta la fecha.
- PUEDO AYUDARTE EN…
Como especialista en cuidados intensivos, puedo ayudarte a darle un cuidado integral, óptimo y de calidad a tus pacientes críticos, sin perder de vista la humanidad que hay en ello. Además, me apasionan la seguridad de paciente y la prevención de las infecciones.
Delegado de ventas de Vygon España en País Vasco, Cantabria , Rioja, Navarra, Burgos y Soria.
- EXPERIENCIA
De formación, soy Licenciado en Ciencias de la Comunicación, rama Periodismo, pero llevo desarrollando toda mi carrera profesional en el sector comercial , ámbito sanitario y biotecnológico
- PUEDO AYUDARTE EN…
Puedo ofrecerte ayuda a la hora de elegir el material médico-quirúrgico que precises para tu labor asistencial.
Delegado especialista Cuidados Intensivos y Anestesia – Emergencias – Madrid – Vygon España
Delegado de ventas – Córdoba, Málaga y Melilla en Vygon España
- EXPERIENCIA
Llevo 32 años en la venta hospitalaria donde he desempeñado varios puestos, responsable de zona de Andalucía, Extremadura y Canarias, responsable de formación y selección de personal. Hace 10 años que soy delegado de ventas de Vygon
- PUEDO AYUDARTE EN…
Mi trabajo se basa en asesoramiento de nuestros productos y técnicas de procedimientos, no dudes en contactar conmigo.
Delegado de ventas – Granada, Almería y Jaén
Bibliografía
- Moureau, N. L., & Flynn, J. (2015). Disinfection of Needleless Connector Hubs: Clinical Evidence Systematic Review. Nursing Research and Practice. https://doi.org/10.1155/2015/796762
- Protocolo Flebitis Zero
- Centros para el Control y Prevención de Enfermedades (CDC)
- O’Grady, N. P., Alexander, M., Burns, L. A., Dellinger, E. P., Garland, J., Heard, S. O., Lipsett, P. A., Masur, H., Mermel, L. A., Pearson, M. L., Raad, I. I., Randolph, A. G., Rupp, M. E., Saint, S., & Healthcare Infection Control Practices Advisory Committee (HICPAC) (2011). Guidelines for the Prevention of Intravascular Catheter-related Infections. Centers for Disease Control and Prevention (CDC) https://www.cdc.gov/infectioncontrol/pdf/guidelines/bsi-guidelines-H.pdf
- Intravascular Quarterly, IQ, Asociación para el Acceso Vascular. (2021, 19 febrero). Needleless Connectors: New Standards, Still Confusing. Issuu. https://issuu.com/avainfo/docs/iq_-_february_2021-final/s/11760015
- Infusion Therapy Standards of Practice. (2016). Journal of Infusion Nursing the Official Publication of the Infusion Nurses Society. https://source.yiboshi.com/20170417/1492425631944540325.pdf
- Gibson, S. M., & Primeaux, J. (2020). Do Needleless Connector Manufacturer Claims on Bidirectional Flow and Reflux Equate to In Vitro Quantification of Fluid Movement? Journal of the Association for Vascular Access, 25(4). https://doi.org/10.2309/java-d-20-00031
- Elli, S., Abbruzzese, C., Cannizzo, L., & Lucchini, A. (2016). In Vitro Evaluation of Fluid Reflux after Flushing Different Types of Needleless Connectors. The Journal of Vascular Access. https://doi.org/10.5301/jva.5000583
- Moureau, N. L. (2019). Vessel Health and Preservation: The Right Approach for Vascular Access. Springer Publishing.
- Webinar: Antonio Verdúo -Tipos de válvulas de seguridad y cuándo utilizar cada una de ellas. https://youtu.be/JBc6yM6FGuY
- Carrillo García, F. (2020, 12 mayo). ¿Cómo evitar la oclusión del catéter? Entrevista a Victoria Armenteros. Campus Vygon. https://campusvygon.com/es/oclusion-victoria-armenteros/
- Consejería De Salud De La Región de Murcia. (Incluido en el banco de preguntas en 2020). Reemplazo de sistemas de infusión y dispositivos complementarios de cateterismos intravasculares centrales para prevenir infecciones. Murcia Salud. https://www.murciasalud.es/preevid/23697
- Consejería De Salud De La Región de Murcia. (Incluido en el banco de preguntas en 2009). ¿La desinfección de los bioconectores es mejor con alcohol de 70º o con solución de clorhexidina? https://www.murciasalud.es/preevid/13756#
- Engelhart, S., Exner, M., & Simon, A. (2015). In vitro study on the disinfectability of two split-septum needle-free connection devices using different disinfection procedures. GMS hygiene and infection control, 10, Doc17. https://doi.org/10.3205/dgkh000260
- Hallam, C. (2019). Right Hub Disinfection for Compliance. Vessel Health and Preservation: The Right Approach for Vascular Access. https://doi.org/10.1007/978-3-030-03149-7_18







0 comentarios