Los agentes infecciosos más frecuentes en pacientes críticos con comorbilidades o estancia hospitalaria prolongada son las bacterias gramnegativas (GNB).
¿QUÉ ENCONTRARÁS EN ESTE ARTÍCULO?
- ¿Qué son las bacterias gramnegativas?
- Mecanismos de resistencia a los antibióticos:
- Producción de enzimas capaces de hidrolizar o inactivar
- Modificación de la ubicación diana del antibiótico en la membrana bacteriana
- Expulsión de los compuestos activos de los antibióticos del interior de la bacteria a través de bombas de eflujo
- Mutación de los genes que codifican las proteínas de tipo porina
- Diagnóstico
- Tratamiento
¿Quieres conocer 13 claves para evitar la infección por bacilos gramnegativos? Permanece en esta página y lee la entrada completa.
Las infecciones bacterianas en los pacientes hospitalizados en la Unidad de Cuidados Intensivos (UCI) son frecuentes y provocan un aumento de la morbilidad y la mortalidad. 7
En especial, la sepsis y el shock séptico son problemas que afectan a millones de personas en todo el mundo cada año. Tal es la gravedad, que entre uno de cada tres y uno de cada seis de los afectados muere. La identificación temprana y el manejo adecuado en las horas iniciales posteriores al desarrollo de la sepsis mejora el pronóstico. 9
Los agentes infecciosos más frecuentes en pacientes críticos con comorbilidades o estancia hospitalaria prolongada, pacientes quirúrgicos y pacientes con dispositivos biomédicos invasivos son las bacterias gramnegativas (GNB). 7
Estos microorganismos están desarrollando una alta resistencia a los antibióticos convirtiéndose en un reto su control para evitar posibles complicaciones que pongan en riesgo la salud del paciente. 7

¿Qué son las bacterias gramnegativas?
Las bacterias gramnegativas se encuentran dentro de una cápsula protectora, la cual les permite evitar que los glóbulos blancos las destruyan. Además, esta membrana externa también las protege contra ciertos antibióticos, como la penicilina. 2
Al deteriorarse la membrana libera sustancias tóxicas llamadas endotoxinas, que son, en gran parte, las responsables de la gravedad de los síntomas en las infecciones por este tipo de bacterias.2
Mecanismos de resistencia a los antibióticos
Los mecanismos de resistencia a los antibióticos pueden clasificarse en cuatro grupos. 7

1. Producción de enzimas capaces de hidrolizar o inactivar
El primer mecanismo consiste en la inactivación enzimática a través de la producción de enzimas capaces de hidrolizar o inactivar varios tipos de antibióticos, en particular los betalactámicos. 7
Se conocen como productores de betalactamasas, que son capaces de ampliar progresivamente su espectro de resistencia.
Las betalactamasas, a su vez, podemos clasificarlas en tres grupos según su:
- Estructura molecular del sitio enzimático activo y las secuencias de aminoácidos. 7
- Perfiles funcionales de hidrólisis e inhibición. 7
- Fenotípicamente, betalactamasas de espectro extendido (BLEE), betalactamasas AmpC, cefalosporinasas y carbapenemasas. Las BLEE inactivan la mayoría de las penicilinas y cefalosporinas, así como el aztreonam. E incluso, a menudo, incorporan genes adicionales o mutaciones que las hace resistentes a otros antibióticos. Las enterobacterias resistentes a los carbapenemes (CRE) se definen como tales cuando se documenta la resistencia a al menos un carbapenem, debido a la producción de carbapenemasas y/o a la amplificación de genes de betalactamasas no carbapenemasas. 7
2. Modificación de la ubicación diana del antibiótico en la membrana bacteriana
El segundo mecanismo de resistencia es a través de la modificación del sitio diana del antibiótico en la membrana bacteriana, modificando las proteínas de unión y evitando así su efecto, o a través de cambios en la polaridad de la membrana para repeler el antibiótico. Un ejemplo de ello lo encontramos en la colistina. 7
3. Expulsión de los compuestos activos de los antibióticos del interior de la bacteria a través de bombas de eflujo
El tercer mecanismo se genera a través de la expulsión de los compuestos activos de los antibióticos del interior de la bacteria a través de bombas de eflujo. Lo encontramos habitualmente en la resistencia a aminoglucósidos, macrólidos y fluoroquinolonas por parte de P. aeruginosa. 7
4. Mutación de los genes que codifican las proteínas de tipo porina
El último mecanismo de resistencia consiste en la mutación de los genes que codifican las proteínas de tipo porina. Ello provoca una disminución de la permeabilidad a los antibióticos. 7
Diagnostico
La identificación del proceso adecuado de forma precoz e inicio del tratamiento desde los primeros signos marcará la diferencia en la evolución. 7
El diagnostico se basa en:
- Presentación clínica. 7
- Anamnesis dirigida. 7
- Exploración física y completa y signos clínicos. 7
- Pruebas de laboratorio e imagen: marcados inflamatorios, procalcitonina y proteinca C reactiva. 8
- Pruebas microbiológicas: siempre que sea posible, deben solicitarse preferentemente antes de iniciar los antibióticos, si no es posible, se comenzará el tratamiento sin demora. 7 En casos graves, además de cultivo orientado, si sospechamos foco debemos extraer hemocultivos 8
- Epidemiología local. 7
Tratamiento
Ante la sospecha de infecciones graves, se debe iniciar un tratamiento antibiótico empírico de forma precoz. 7 En función de la gravedad clínica varían las recomendaciones para el inicio del tratamiento antibiótico.
En un paciente que presenta cuadro de sepsis (disfunción orgánica potencialmente mortal causada por una respuesta disregulada del huésped a la infección)8, se recomienda iniciar la terapia antimicrobiana en las primeras tres horas9, teniendo en cuenta las siguientes consideraciones: 7
- Contexto del huésped, factores de riesgo como las comorbilidades, el estado inmunológico y nutricional, la edad, el sexo, la exposición a antibióticos en los últimos 30 días, la quimioterapia u otros tratamientos relevantes. 7
- Fuente de la infección, el órgano o el dispositivo biomédico. 7
- Epidemiología local y los patrones de susceptibilidad, y la resistencia a los antibióticos en los últimos seis meses. 7
- Guías clínicas desarrolladas para determinadas infecciones. 7
En caso de shock séptico, considerado como una subcategoría de la sepsis en la que las alteraciones circulatorias y del metabolismo celular son lo suficientemente profundas como para aumentar considerablemente la mortalidad y describiendo los criterios para su definición como hipotensión, requerimiento sostenido de vasopresores para mantener una presión arterial media (PAM) =65 mmHg y un nivel de lactato sérico mayor de 2 mmol/L; 8 se recomienda iniciar la administración de antibióticos de amplio espectro en la primera hora. 7,9
En todos los casos el factor tiempo es de alta relevancia tanto para el inicio de antibiótico como cuando el manejo quirúrgico esté contemplado como fuente de control del foco de la infección, ya que el retraso aumentará tanto la morbilidad como la mortalidad. 7
¿Cómo actuar ante bacterias gramnegativas?
Dada la situación actual epidemiológica y los cambios en los patrones de resistencia antimicrobianos debemos tener connotaciones especiales para el manejo antibiótico de las infecciones por BGN.
Las bacterias gramnegativas (GNB) productoras de β-lactamasa de espectro extendido (BLEE) están aumentando su incidencia sobre todo en los pacientes críticos. Son resistentes a todos los betalactámicos, a excepción de las cefamicinas y los carbapenems. 7
Por su parte la cefoxitina, el cefotetán y el cefamandol no se recomiendan como opciones de tratamiento debido al riesgo de desarrollar resistencia al antibiótico. 7
En el caso de infecciones graves, los carbapenems son el tratamiento de elección. Están considerados como los únicos capaces de mantener la actividad bactericida durante 24 horas frente a inóculos elevados, a excepción del ertapenem. 7
Entre ellos, en el caso de shock séptico, se recomienda principalmente el meropenem y el imipenem. Si se trata de infecciones leves, la piperacilina/tazobactam y la amoxicilina/ácido clavulánico o las fluoroquinolonas pueden ser una opción. 7
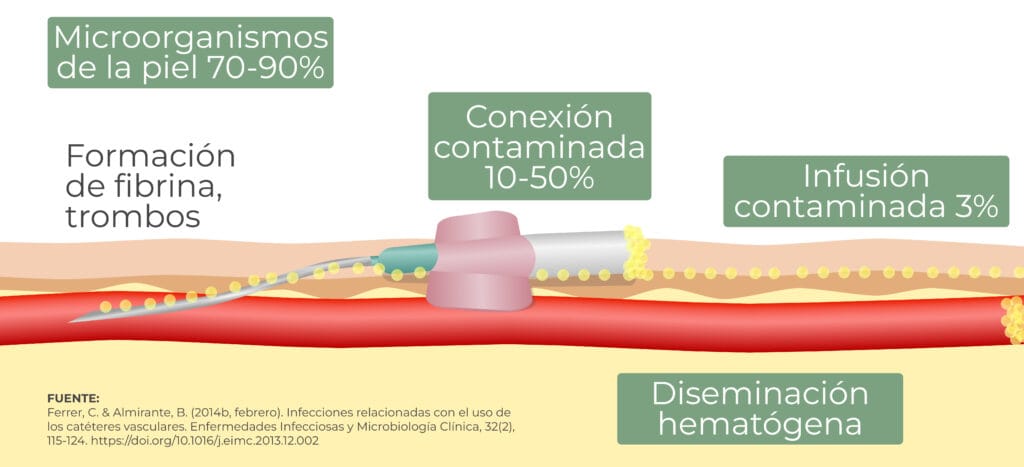
Claves para evitar la infección por bacilos gramnegativos
1. Higiene de manos
Se debe realizar una adecuada higiene de manos antes y después de palpar los lugares de inserción de los catéteres, así como antes y después de insertar, remplazar, acceder, reparar o proteger un catéter intravascular. 4
Este procedimiento se realizará incluso al utilizar guantes.4
2. Uso de clorhexidina en la preparación de la piel
Se deberán guardar las máximas precauciones durante la colocación del catéter, y se deberá desinfectar la piel con un antiséptico apropiado antes de la inserción del catéter. 4
La solución más recomendada es una preparación de clorhexidina acuosa al 2% o alcohólica al 0,5%. Si existe una contraindicación para el uso clorhexidina se pueden utilizar soluciones alcohólicas yodadas. 4
El antiséptico utilizado debe secarse completamente después de la aplicación en la piel y previamente a la inserción del catéter. 4
3. Medidas de barrera total
La adopción de barreras de máxima esterilidad (gorro, mascarilla, bata estéril, guantes estériles, paño estéril grande que cubra al paciente y funda estéril para el ecógrafo) durante la inserción de CVC reduce significativamente la Bacteriemia Relacionada con el Catéter (BRC). 4
4. Acceso venoso
A lo largo de los años se han realizado diversos estudios con el fin de evaluar cuál es el acceso venoso que presenta menores complicaciones, ya que la elección del sitio de inserción del catéter venoso central tiene repercusión en la tasa de infección. 5
Estas investigaciones concluyen que la vena subclavia es la que presenta menor riesgo de infección del torrente sanguíneo y trombosis sintomática, por lo que será la preferente. 4,5
No obstante, hay que considerar más factores como las posibles complicaciones mecánicas, el riesgo de estenosis de la vena subclavia o la experiencia del profesional con el dispositivo. 4
5. Utilización de ecografía
Su uso permite localizar con mayor facilidad la vena y medir la profundidad a la que se introduce por debajo de la piel, reduciendo los errores y complicaciones durante la punción. 4,6
6. Check list de inserción
Un check-list aumenta la conciencia sobre las medidas antisépticas necesarias en la inserción de los CVCs, contribuyendo a la mejorara del procedimiento. 6
7. Manejo higiénico de los catéteres
Toda intervención sobre el catéter supone un riesgo de infección, por ello se recomienda reducir al mínimo imprescindible la manipulación de conexiones y limpiar los puntos de inyección del catéter con alcohol isopropílico de 70º antes de acceder con ellos. 4,6
Además, se deben sustituir los equipos de infusión, alargaderas y conectores utilizados forma continuada, con una frecuencia no inferior a 96 horas, pero al menos cada 7 días o desde el momento en que las conexiones estén visiblemente sucias o en caso de desconexión accidental. Aunque esta es la recomendación general, se recomienda consultar esta información con el fabricante. 4
En el caso de nutrición parenteral el cambio de equipos se realizará cada 24h y de emulsión lipídica el cambio de equipos se realizará cada 6-12 horas. 4
8. Uso de catéteres impregnados con antimicrobianos
Los catéteres microbianos previenen la colonización asociada al catéter, la infección local y la infección del torrente sanguíneo. 4
9. Uso de apósitos impregnados con clorhexidina y uso de tampones con solución antiséptica en los conectores
Los apósitos impregnados con clorhexidina también pueden ser de gran ayuda para reducir la infección. 4
10. Higiene corporal diaria con clorhexidina
La higiene corporal diaria evitará que se introduzcan en el dispositivo bacterias procedentes de la piel. 4
11. Retirar catéteres innecesarios
La duración del cateterismo está relacionada con la ocurrencia de BRC, por ello siempre que sea posible se retirarán catéteres innecesarios. 6
Se debe evaluar, al menos una vez al día, la necesidad de los dispositivos vasculares que lleva el paciente. 4
12. Cultivos de detección activa
Los cultivos de detección activa identifican a los pacientes que presentan infección y facilitan su manejo. 7
13. Tratamiento precoz
Ante la sospecha de infecciones graves, se debe iniciar un tratamiento antibiótico empírico de forma precoz. 7

Evitar la infección por bacilos gramnegativos puede llegar a convertirse en todo un desafío debido a la alta resistencia a los antibióticos que están desarrollando estos microrganismos, no obstante, estas medidas ayudarán a evitar la infección y posibles complicaciones relacionadas.
Bibliografía
- Guidelines on Core Components of Infection Prevention and Control Programmes at the National and Acute Health Care Facility Level. Geneva: World Health Organization; 2016. 6, The burden of health care-associated infection. Available from: https://www.ncbi.nlm.nih.gov/books/NBK401766/
- Bush, L. M. (2022, 27 octubre). Introducción a las bacterias gram negativas. Manual MSD versión para público general. https://www.msdmanuals.com/es-cl/hogar/infecciones/infecciones-bacterianas-bacterias-gramnegativas/introducci%C3%B3n-a-las-bacterias-gram-negativas
- García-Rodríguez, Julio. de Pablos Gómez, Manuela. Gutiérrez Altés, Avelino. (2010). El microbiólogo y la infección asociada a catéter en Revista Española de Quimioterapia. Vol. 23, Nº. 2. ISSN-e 0214-3429 https://seq.es/seq/0214-3429/23/2/garciarodriguez.pdf
- Bacteriemia Zero
- Parienti J, Mongardon N, Mégarbane B. Intravascular complications of central venous catheterization by insertion site. The new england journal of medicine. Septiembre 2015;373:13.
- A. Hernández-Aceituno, V. Vega-Costa, M. Ruiz-Álvarez, A. Figuerola-Tejerina, R. Méndez-Hernández, F. Ramasco-Rueda. Efectividad de un paquete de medidas para reducir las bacteriemias asociadas a catéter venoso central. Revista Española de Anestesiología y Reanimación. DOI: 10.1016/j.redar.2019.11.014
- Dhaese, S., Machado, M. C., Bautista-Aguilar, G. A., Ganapathiraju, I., Haddad, S. F., Lakbar, I. & Algethamy, H. M. (2022). ICU Management & Practice. Antibiotic Resistance (Vol. 4) [Https://healthmanagement.org/c/icu/issue/volume-22-issue-4-2022]. Jean-Louis Vincent.
- Singer M, Deutschman CS, Seymour CW, Shankar-Hari M, Annane D, Bauer M, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA. 2016;315(8):801-10.
- Surviving sepsis campaign: international guidelines for management of sepsis and septic shock 2021. Intensive Care Med. 2021 Nov;47(11):1181-12





0 comentarios