Se estima que se producen 49 millones de casos de sepsis y 11 millones de muertes asociadas cada año.2
Ante un paciente con sepsis, uno de los objetivos principales es aumentar el gasto cardíaco y mejorar la oxigenación de los tejidos, si no lo conseguimos a tiempo la vida del paciente estará en peligro. Para evitarlo, la fluidoterapia tiene un papel clave, pero es imprescindible tener en cuenta algunas precauciones para conseguir el resultado esperado.1,2
¿QUÉ ENCONTRARÁS EN ESTE ARTÍCULO?
- Fluidoterapia en el paciente séptico
- ¿Cómo saber qué cantidad de fluido precisa mi paciente?
- ¿Cuáles son los indicadores de sobrecarga de fluido?
- ¿Cómo evitar interacción entre cada una de las infusiones intravenosas?
¿Quieres saber más sobre infusión intravenosa en el paciente séptico? Permanece en esta página y lee la entrada completa.
La sepsis supone un desafío para los profesionales de la salud a nivel mundial, se estima que se producen 49 millones de casos y 11 millones de muertes asociadas cada año.2
Ante un paciente con sepsis, uno de los objetivos principales es aumentar el gasto cardíaco y mejorar la oxigenación de los tejidos, si no lo conseguimos a tiempo la vida del paciente estará en peligro. Para evitarlo, la fluidoterapia tiene un papel clave, pero es imprescindible tener en cuenta algunas precauciones para conseguir el resultado esperado.1,2
Fluidoterapia en el paciente séptico
La fluidoterapia es una técnica desafiante, ya que no existe fórmula que funcione por igual en todos los pacientes, si no que requiere una cuidadosa evaluación que permita conocer las necesidades individuales en cada caso.1
Debido al deterioro generalizado, en el cual se incluyen daños respiratorios, hemodinámicos o renales, es habitual que los pacientes precisen múltiples fármacos en perfusión continua, algunos de ellos de alto riesgo y con consideraciones especiales en su manejo.
Podemos encontrarnos, por ejemplo, un paciente con necesidad de IOT, precisando analgosedación y relajación con bloqueantes neuromusculares. Y, a su vez, será preciso soporte hemodinámico con drogas vasoactivas, y soporte renal con perfusión continua de un diurético.
¿Quieres saber más sobre monitorización hemodinámica en el paciente séptico?
Cuando nos encontramos ante pacientes que precisan múltiples infusiones intravenosas es habitual preguntarse cómo gestionarlas para evitar posibles interacciones que pongan en peligro la salud del paciente.
En este post nos plantearemos tres de las preocupaciones más importantes relacionadas con la infusión intravenosa en pacientes sépticos:
- ¿Cómo saber qué cantidad de fluido precisa mi paciente?
- ¿Cuáles son los indicadores de sobrecarga de fluido?
- ¿Cómo evitar interacción entre cada una de las infusiones intravenosas?
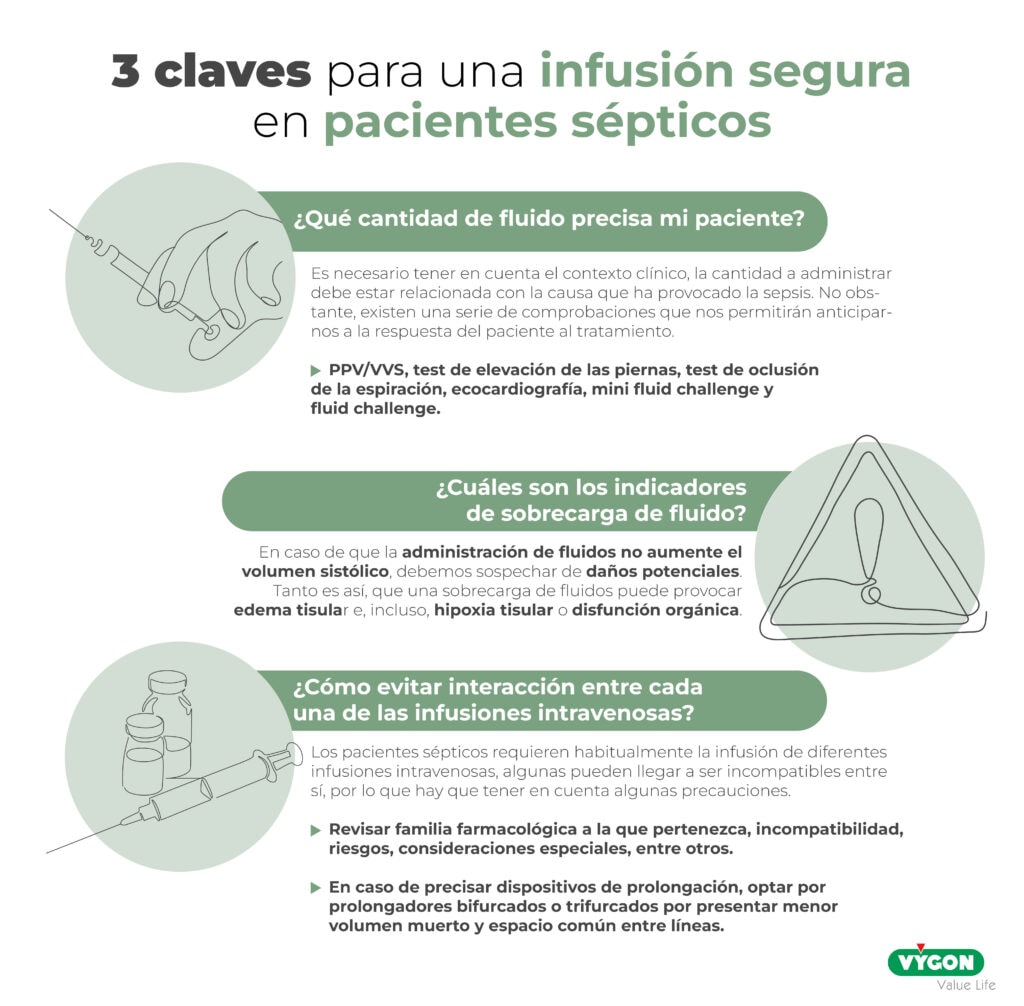
1. ¿Cómo saber qué cantidad de fluido precisa mi paciente?
Obviamente es necesario tener en cuenta el contexto clínico, la cantidad a administrar debe estar relacionada con la causa que ha provocado la sepsis. No obstante, existen una serie de comprobaciones que nos permitirán anticiparnos a la respuesta del paciente al tratamiento.
Entre ellas encontramos la PPV/VVS, el test de elevación de las piernas, el test de oclusión de la espiración, la ecocardiografía, el mini fluid challenge y el fluid challenge.
¿Te preguntas cómo saber qué cantidad de fluido precisa el paciente?
2. ¿Cuáles son los indicadores de sobrecarga de fluido?
En caso de que la administración de fluidos no aumente el volumen sistólico, debemos sospechar de daños potenciales. Tanto es así, que una sobrecarga de fluidos puede provocar edema tisular e, incluso, hipoxia tisular o disfunción orgánica.14
No obstante, en pacientes sépticos es habitual encontrar insuficiencia cardíaca previa, alrededor del 54% con disfunción diastólica y el 23% con disfunción sistólica, la cual puede empeorar con la administración de líquidos. 14
El sobre estiramiento del ventrículo izquierdo provoca una dilatación deteriorada de este, lo que lleva a edema pulmonar, hipertensión pulmonar y disfunción del ventrículo derecho. 14
3. ¿Cómo evitar interacción entre cada una de las infusiones intravenosas?
Como hemos comentado anteriormente, los pacientes sépticos requieren habitualmente la infusión de diferentes infusiones intravenosas, algunas pueden llegar a ser incompatibles entre sí, por lo que hay que tener en cuenta algunas precauciones.
Comenzando por el catéter, el dispositivo venoso empleado para este tipo de medicación será central, independientemente de su acceso.
En este escenario, un problema importante con el que nos encontramos es la dificultad de poner toda esa medicación en perfusión continua. Siendo, lógicamente, más dificultosa cuantas menos luces tenga nuestro catéter.
Aspectos como la familia farmacológica a la que pertenezca, incompatibilidad, riesgos, consideraciones especiales, entre otros, son fundamentales para que la instauración y la continuidad del tratamiento farmacológico sean óptimos.
Es habitual encontrarnos, con múltiples fármacos para solo, por ejemplo, 3 luces venosas, por lo que alguno de ellos deberá compartir la misma luz. Cuando esto sucede, necesitamos un acceso que permita varios procedimientos de infusión o extracción como son las rampas o prolongadores de varias vías.
¿Rampas o prolongadores bifurcados/trifurcados?
Aunque en función puedan parecer similares, en términos de seguridad tienen algunas diferencias que hacen que esta elección tenga más relevancia de lo que un primer momento se puede llegar a pensar.
En la situación descrita anteriormente, nos encontramos con perfusión continua de propofol, remifentanilo, cisatracurio, noradrenalina y furosemida. El objetivo práctico, además de poner las perfusiones de una manera que se respeten determinadas indicaciones propias de cada medicamento, teniendo precaución con la dosis y ritmo de perfusión de cada una de ellas, es administrar las perfusiones, intentando evitar cualquier interacción medicamentosa no deseada que se pueda producir, manteniendo la estabilidad y contribuyendo a la administración segura de los mismos.
¿Te preguntas cómo saber qué cantidad de fluido precisa el paciente?
Volumen muerto
Las rampas son dispositivos con un alto volumen muerto, por lo cual es difícil conocer con exactitud el tiempo y volumen de llegada del fármaco al torrente sanguíneo del paciente.
Si esto ya es un problema en llaves de tres pasos, en las rampas se ve incrementado, ya que; aunque, las rampas permiten que múltiples infusiones se conecten a un solo puerto, al hacerlo, agregan volumen muerto. 4
Este volumen muerto puede retrasar o precipitar la infusión 3,4, incluso llegando a producirse interacción entre los diferentes fármacos.
Al conectar varias infusiones intravenosas en estos dispositivos, debido al volumen muerto, cualquiera de los fluidos infundidos puede cambiar 3:
- Tasa de flujo total.
- Concentración de cada una de las sustancias.
Estas modificaciones pueden tener efectos impredecibles para el paciente. Además, a medida que se conectan más infusiones, aumenta la complejidad y probabilidad de que estos cambios se produzcan.
Espacio común entre líneas
Como hemos comentado, muchos pacientes precisan de varios fármacos y fluidos administrados al mismo tiempo, de ahí la necesidad de este tipo de dispositivos de administración intravenosa.
Pero, además, estos tratamientos pueden presentar incompatibilidad entre ellos, por lo que, lo ideal es contar con dispositivos que cuenten con el menor espacio común posible entre las líneas, evitando, de esta forma, la interacción entre las diferentes soluciones.
No obstante, independientemente del dispositivo empleado, debemos apoyarnos en recursos con evidencia científica que nos muestren la compatibilidad en Y de diversos fármacos. Estos recursos pueden ser desde guías, protocolos e incluso APPs.
Otros riesgos de las rampas
La infección y el cracking son otros dos riesgos que, unidos a la falta de control sobre la infusión y la posible interacción entre los diferentes fármacos, están relacionados con las rampas.
Tanto es así, que las recomendaciones para la práctica clínica de la CDC del 2011 cuentan con un apartado específico acerca de los conectores sin agujas, donde se hace referencia a las llaves de tres pasos:
Las llaves de 3 pasos utilizadas para la inyección de medicamentos, la administración de infusiones intravenosas y la recogida de muestras de sangre representan una puerta potencial de entrada de microorganismos en los catéteres de acceso vascular y en los fluidos intravenosos.
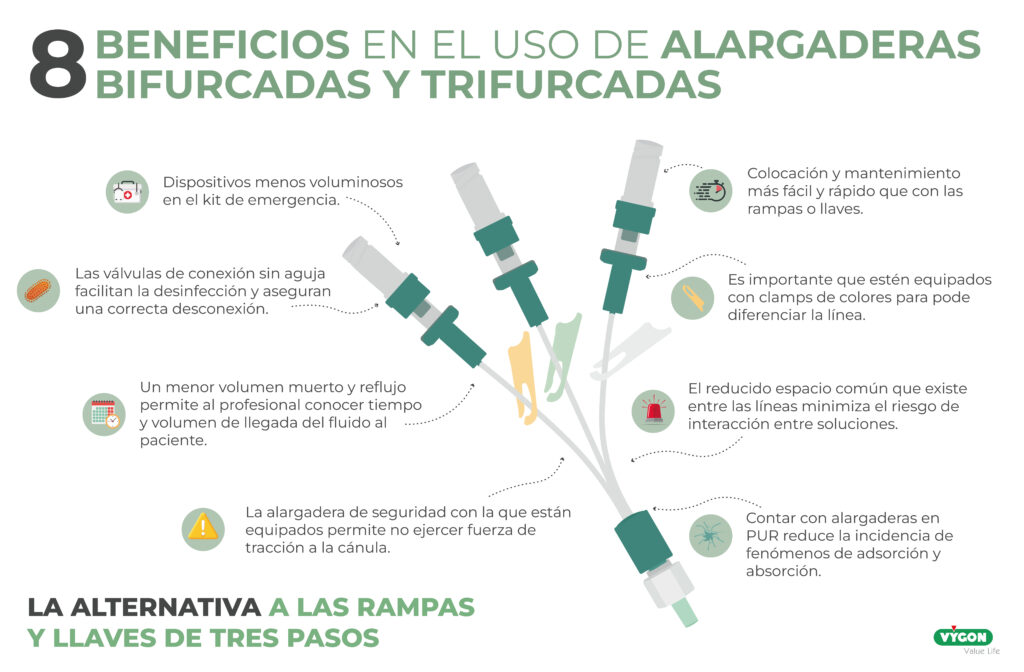
Con el uso de alargaderas bifurcadas y trifurcadas estos riesgos se reducen. Comenzando con los dos primeros, las alargaderas bifurcadas y trifurcadas guardan un menor especio común entre líneas, así como un menor volumen muerto, por lo que es posible conocer de forma más exacta el tiempo y el volumen de llegada de los fluidos.
Además, el volumen muerto tiene incidencia en la probabilidad de interacción entre los diferentes fármacos, por lo que contar con alargaderas bifurcadas o trifurcadas reducirá esta problemática notablemente.
Con respecto a la infección, los prolongadores bifurcados y trifurcados son sistemas cerrados sin aguja, tal como recomienda la CDC para prevenir la infección del torrente sanguíneo.
Por último, el cracking, es el cuarteamiento o rotura de los dispositivos al exponerse a sustancias químicas agresivas, como algunos desinfectantes o fármacos, así como, debido a la tensión ejercida al enroscar el luer. Suele producirse en las rampas debido al material de fabricación y la necesidad de manipulación de los tapones, algo que no sucede con los prolongadores bifurcados o trifurcados.
Bibliografía
- Monnet, X., Lai, C. & Teboul, JL. How I personalize fluid therapy in septic shock?. Crit Care 27, 123 (2023). https://doi.org/10.1186/s13054-023-04363-3
- Macdonald S. Fluid Resuscitation in Patients Presenting with Sepsis: Current Insights. Open Access Emerg Med. 2022 Nov 29;14:633-638. doi: 10.2147/OAEM.S363520. PMID: 36471825; PMCID: PMC9719278.
- Cassano-Piché, A., Fan, M., Sabovitch, S., Masino, C., Easty, A. C., Health Technology Safety Research Team, & Institute for Safe Medication Practices Canada (2012). Multiple intravenous infusions phase 1b: practice and training scan. Ontario health technology assessment series, 12(16), 1–132.
- Lovich MA, Wakim MG, Wei A, Parker MJ, Maslov MY, Pezone MJ, Tsukada H, Peterfreund RA. Drug infusion system manifold dead-volume impacts the delivery response time to changes in infused medication doses in vitro and also in vivo in anesthetized swine. Anesth Analg. 2013 Dec;117(6):1313-8. doi: 10.1213/ANE.0b013e3182a76f3b. PMID: 24257380.
- Teboul JL, Monnet X. “etección de la capacidad de respuesta al volumen y la falta de respuesta en pacientes de la unidad de cuidados intensivos: dos problemas diferentes, una sola solución. Cuidado crítico. 2009; 13 (4): 175. doi: 10.1186 / cc7979.
- Bagshaw SM, Brophy PD, Cruz D, Ronco C. Balance de fluidos como biomarcador: impacto de la sobrecarga de fluidos en el resultado en pacientes críticos con lesión renal aguda. Cuidado crítico. 2008; 12 (4): 169. doi: 10.1186 / cc6948.
- Malbrain MLNG, Van Regenmortel N, Saugel B, et al. Principles of fluid management and stewardship in septic shock: it is time to consider the four D’s and the four phases of fluid therapy. Ann Intensive Care. 2018;8(1):66. Published 2018 May 22. doi:10.1186/s13613-018-0402-x
- Weil MH, Henning RJ. New concepts in the diagnosis and fluid treatment of circulatory shock. Thirteenth annual Becton, Dickinson and Company Oscar Schwidetsky Memorial Lecture. Anesth Analg. 1979;58(2):124–132. doi: 10.1213/00000539-197903000-00013.
- Monnet X, Teboul JL. Passive leg raising: five rules, not a drop of fluid! Crit Care. 2015;19:18. doi: 10.1186/s13054-014-0708-5.
- Jozwiak M, Depret F, Teboul JL, Alphonsine JE, Lai C, Richard C, Monnet X. Predicting fluid responsiveness in critically ill patients by using combined end-expiratory and end-inspiratory occlusions with echocardiography. Crit Care Med. 2017;45(11):e1131–e1138. doi: 10.1097/CCM.0000000000002704.
- Hoste EA, Maitland K, Brudney CS, et al. Four phases of intravenous fluid therapy: a conceptual model. Br J Anaesth. 2014;113(5):740–747. doi:10.1093/bja/aeu300
- Rivers E, Nguyen B, Havstad S, Ressler J, Muzzin A, Knoblich B, Peterson E, Tomlanovich M. Terapia temprana dirigida a objetivos en el tratamiento de sepsis severa y shock séptico. N Engl J Med. 2001; 345 (19): 1368-1377. doi: 10.1056 / NEJMoa010307.
- Ángel A. Pérez-Calatayud, Manuel A. Díaz-Carrillo, Eduardo D. Anica-Malagón y Jesús C. Briones-Garduño. Nuevos conceptos de la reanimación hídrica intravenosa
- Chien, Christina. 2018. Reanimación con fluidos. https://isaem.net/reanimacion-con-fluidos/






0 comentarios