La Dra. Sonia Brió, coordinadora UCI Pediátrica del hospital de la Santa Creu i Sant Pau, expone en el curso “Casos prácticos de monitorización hemodinámica con método P.R.A.M en pediatría”, un caso de síndrome de lisis tumoral.
El síndrome de lisis tumoral es una emergencia metabólica derivada de la rápida y masiva destrucción de células tumorales.
Esta patología produce un gran desequilibrio del medio interno, provocando graves trastornos en el estado hemodinámico y una gran catástrofe metabólica con trastornos iónicos muy importantes.
En estos pacientes, una adecuada monitorización puede ayudar en el manejo del síndrome de lisis tumoral y sus complicaciones.
Caso clínico
El caso práctico expuesto por la Dra. Sonia Brió es el de un paciente de 11 años que ingresa en UCIP procedente de urgencias por insuficiencia respiratoria aguda en el contexto de una masa abdominal en estudio.
Con respecto a sus antecedentes patológicos, había tenido a los 2 años un rabdomiosarcoma cervical izquierdo que, en principio, estaba en remisión completa.
Acude a urgencias por disnea progresiva asociada a fiebre en el contexto de dolor abdominal y diarreas. En la exploración física inicial destaca hipoventilación del hemitórax derecho y palpación de una masa abdominal pétrea en hipocondrio y flanco derecho.
Se realiza analítica, hemocultivo, radiografía de tórax y ecografía abdominal. Se observa un derrame pleural bilateral de predominio derecho.
También se realiza una ecografía abdominal y una resonancia magnética abdominal.
ECOGRAFÍA ABDOMINAL
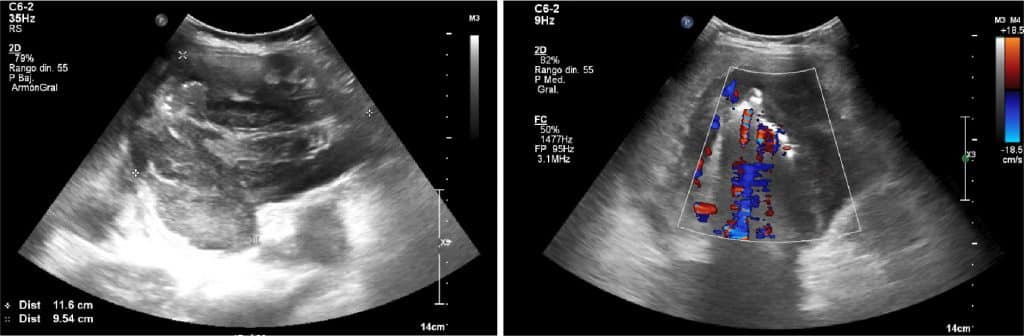
En la ecografía abdominal, se observa una masa intraperitoneal de aprox. 10 cm de diámetro máximo localizado en el hemiabdomen derecho, de aspecto heterogéneo y con flujo al Doppler color.
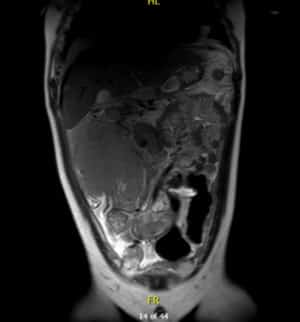
Resonancia magnética
Por su parte, en la resonancia magnética se observa una masa voluminosa infiltrativa en flanco derecho que mide 140 x 120 x150 mm, íntima relación con área ileocecal y colon ascendente al que rodea en su totalidad sin condicionar obstrucción.
Estas pruebas hacían pensar en un linfoma de Burkitt.
Tras ello, el paciente ingresa en la en UCIP y se le coloca soporte respiratorio con CPAP. Se inicia tratamiento con hiperhidratación y prevención de síndrome de lisis tumoral inicialmente con alopurinol, pero ante la gran masa, posteriormente se continua con rasburicasa.
En la UCIP se intenta realizar una biopsia percutánea de la masa, sin éxito por lo que se traslada a quirófano para realizar biopsias quirúrgicas.
Se coloca un port a cath y se realizan las biopsias con una mini laparoscopia que, en principio, no da problemas pero que en el postoperatorio inmediato, el paciente presenta una parada cardiorrespiratoria, inicialmente en asistolia y posteriormente a ritmo desfibrilable: una fibrilación ventricular, que precisa maniobras de reanimación avanzada durante 14 minutos. Durante la reanimación el paciente recibe carga de cristaloides, bicarbonato sódico y una dosis de calcio.
Cuando se recupera la circulación espontánea se realiza una gasometría que muestra:
- K: 8,7 mmol/l
- pH: 7,21
- HCO3: 16,5mmol/l
- EB: -10,7mmol/l
Se optimiza tratamiento médico de la hiperpotasemia con gluconato cálcico, insulina, bicarbonato, salbutamol y furosemida, con lo que se consigue un descenso en la cifra de potasio, que se mantiene entre 5,5-6,5mmol/l.
Síndrome de lisis tumoral
El síndrome de lisis tumoral es una urgencia oncológica causada por la destrucción masiva de células tumorales con la liberación de componentes intracelulares a la circulación: K +, fosfato y ácidos nucleicos y metabolitos intracelulares.
Se trata de una complicación potencialmente grave, que puede provocar una insuficiencia renal aguda, arritmias cardíacas, convulsiones, alteraciones neurológicas e incluso la muerte.
Por norma general, se suele desarrollar en los primeros días después de iniciar tratamiento citotóxico, aunque también puede observarse de forma espontánea previa al inicio del mismo, como sucede en este caso.
Síntomas
- Náuseas
- Convulsiones
- Rampas
- Arritmias
- Parada cardiorrespiratoria
- Tetania
- Letargia
Factores de riesgo
Existen una serie de factores que aumentan la probabilidad de sufrir una lisis tumoral y que dependerán de:
Tipo de tumor.
- Linfoma de Burkit.
- Linfoma Linfoblástico
- Linfoma difuso de Células grandes B Leucemia Aguda Linfoblástica
- Tumor sólido con elevada proliferación
Carga tumoral/extensión.
- Medida >10cm.
- LDH elevada (>2x límite superior normal).
- Leucocitosis > 25.000/mcl
Función renal
- Fallo renal preexistente/infiltración renal
- Oliguria
Nivel básico de ácido úrico
- >7,5mg/dl
Tratamiento citorreductor efectivo, rápido
- Tratamiento específico de cada tumor
Criterios diagnósticos
En los criterios diagnósticos del síndrome de lisis tumoral se incluyen alteraciones metabólicas y cuadros clínicos.
Las alteraciones metabólicas vienen definidas principalmente por los niveles de:
- Ácido úrico
- Potasio
- Fósforo
- Calcio
Con respecto al síndrome de lisis tumoral clínico, ha de cumplir como mínimo uno de los siguientes escenarios:
- Fallo renal definido por una creatinina ≥ 1,5 por el límite superior de la normalidad ajustado según edad del paciente
- Arritmia cardiaca
- Muerte súbita
- Crisis convulsiva
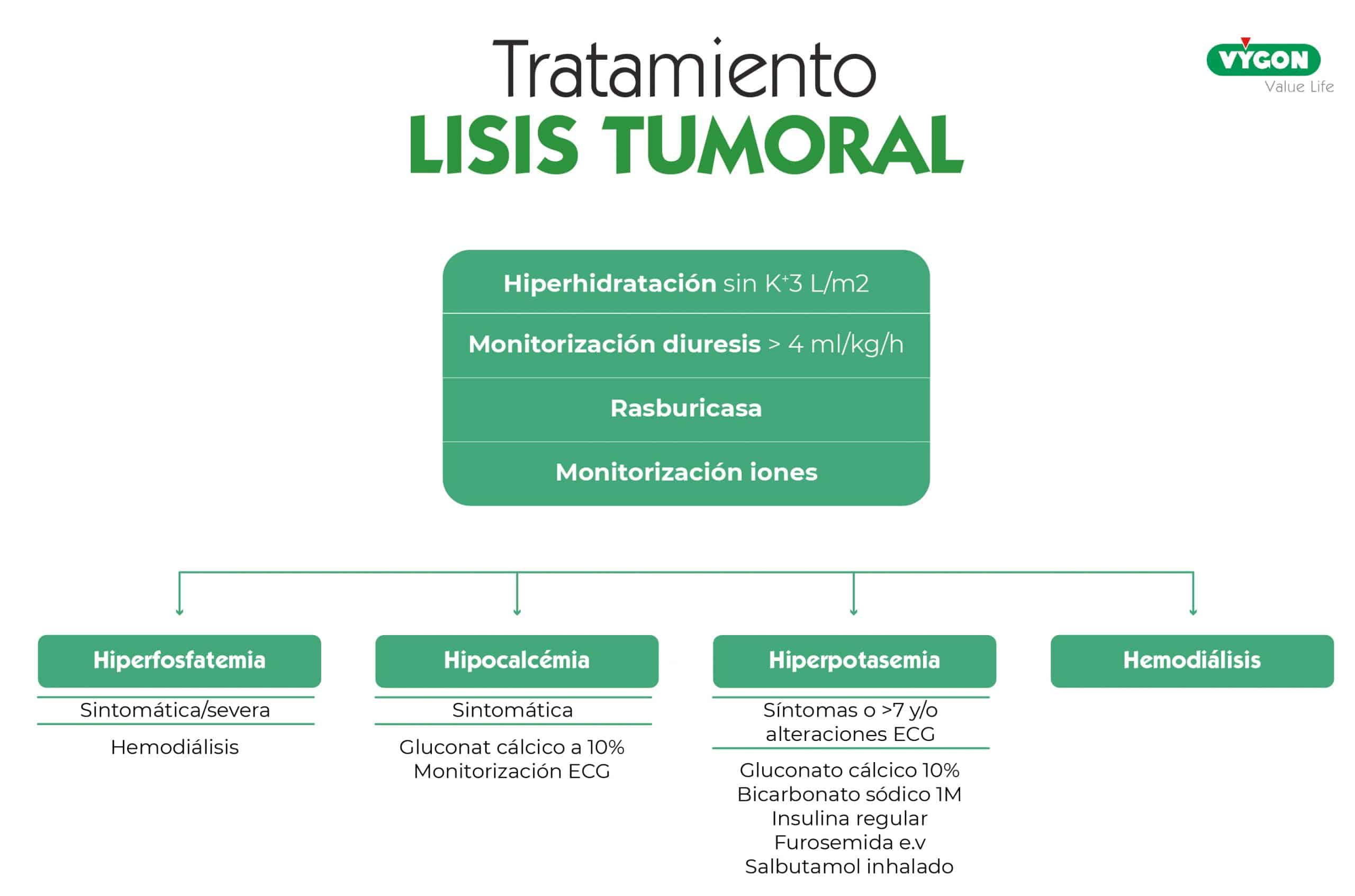
Tratamiento
El tratamiento, que ya se había comenzado a administrar al paciente incluye:
- Hiperhidratación sin K+ 3 L/m2
- Monitorizacióń diuresis > 4 ml/kg/h
- Rasburicasa
- Monitorización iones
Retos
El paciente continuo con diselectrolitemias con respuesta parcial a tratamiento médico tras la salida del paro cardiorrespiratorio, lo que constituyó uno de los principales retos a los que hubo que enfrentarse.
Se trataba de un paciente que llevaba hiperhidratación como tratamiento de la lisis tumoral, y que, tras el paro cardiorrespiratorio, presentó un fallo renal agudo y cayó en cuadro de shock con hipotensión arterial refractaria a líquidos.
Y, al recuperar la circulación espontánea presentó un edema pulmonar.
Desarrollo
El paciente llegó de quirófano intubado con:
- FiO2 inicial 100%
- PEEP 10cmH20.
- Vt inicial 8ml/kg
Además, presentaba taquicardia sinusal a 200x’, con hipotensión arterial franca, para su edad, de 65/38.
Con respecto al tratamiento, salió de quirófano con una bomba de adrenalina a 1ug/kg/min. Y se comenzó con la monitorización de BIS, para el plano de sedación, e INVOS para la saturación regional.
No obstante, se precisaba más información para ajustar correctamente el tratamiento y poder tomar decisiones sobre la priorización de unos fármacos sobre otros.
Por ello, se procedió a:
- Monitorización hemodinámica: se canalizó una arteria radial y se procedió a la monitorización hemodinámica con el monitor MostCare Up.
Si hay una arteria, la máxima es monitoriza
- Ecografía a pie de cama: ecocardiografía para evaluar la función cardiaca, ecografía torácica para mejorar el manejo de líquidos y ecografía dopper transcraneal para control post paro de flujos cerebrales y velocidades.
- Hemofiltración veno-venosa continua: Se canalizó un Sheldon en vena femoral para comenzar la hemofiltracion veno-venosa continua.
Monitorización hemodinámica con MostCare UP
Tras la canalización arterial se conecta MostCare Up y se comienza la monitorización hemodinámica obteniendo los siguientes resultados:
- IC: 2’5 L/min/m2.
- SVRI: 847 dinas x seg x m2/cm5
- VPP: 38%
- CCE: -0,25
- dP/dt: 0,79
- Ea: 0,78
Con los datos del monitor, se ajusta el tratamiento a las necesidades del paciente:
- Se inicia tratamiento con noradrenalina, con el cual se consiguió subir el índice cardiaco y las resistencias.
- Carga de volumen 10ml/kg. para poder conectarlo a la hemodiafiltración veno-venosa continua.
- Tras visualizar los datos del monitor, ya se esperaba una contractilidad alterada. Se realizó una ecocardio que indicó contractilidad FE 45%, y una vena cava colapsable.
Con este tratamiento se consiguió mejorar la hemodinámica, consiguiendo estabilizar poco a poco al paciente, con unos datos de:
- IC: 4’5 L/min/m2.
- SVRI: 1600 dinas x seg x m2/cm5
- VPP: 18%
- CCE: 0,25
- dP/dt: 0,91
- Ea: 1,1
El paciente presentó un fallo multiorgánico post-parada cardiorrespiratoria con fallo renal KDIGO 3, síndrome de distrés respiratorio agudo (SDRA) moderado-grave y fallo hepático.
Al día siguiente comenzó a estabilizarse, mostrando una mejoría progresiva, tras la que fue posible la extubación electiva a los 9 días y descontinuar la HDFVVC a los 11 días.
Se confirma Linfoma de Burkitt estadio III por lo que el décimo día de ingreso se inicia tratamiento quimioterápico según protocolo COP + COPADM + CYM + Rituximab.
El paciente mostró mejoría clínica progresiva con estabilización clínica y de la función renal, llegando a recuperarse del todo, y se trasladó a sala de hospitalización para completar tratamiento.
Han pasado 11 meses desde su hospitalización y actualmente el paciente continúa sin enfermedad mínima residual.
Complicaciones
Las complicaciones a las que tuvieron que enfrentarse, principalmente al llegar a la UCIP, fue la dificultad en el manejo de líquidos y vasopresores/inotrópicos en pacientes con SDRA, shock tóxico e insuficiencia renal aguda.
Ventajas de la monitorización
La monitorización ayuda a ir tomando decisiones progresivas que lleven a la recuperación del paciente. En este caso clínico se sirvieron de diferentes herramientas de monitorización:
- Ecocardiografía: valoración función cardiaca y estado vascular a cortes puntuales.
- Ecografía torácica: valoración sobrecarga de volumen en cortes puntuales.
- Ecografía-Doppler transcraneal: control flujos cerebrales en cortes puntuales.
- BIS®: adecuado nivel de sedación de forma continua.
- INVOs®: monitorización continua en tiempo real de los cambios en la saturación regional de oxígeno.
- Mostcare®: monitorización continua y tendencias del estado hemodinámico del paciente grave. También, en pacientes con hemodiálisis con hemofiltración venovenosa continua y en pacientes pediátricos. Disponer del monitor permite tratamientos dirigidos y anticiparse a posibles complicaciones.
Este caso clínico de síndrome de lisis tumoral presentado por la Dra. Sonia Brió podrás encontrarlo, junto a otras tres presentaciones realizadas por profesionales de diferentes puntos de España, en nuestro curso “Casos prácticos de monitorización hemodinámica con método P.R.A.M en pediatría”. Para acceder al curso debes hacer clic aquí o en el banner anterior.
Te puede interesar
- POSTOPERATORIO DE CIRUGÍA CARDÍACA PEDIÁTRICA, UN CASO CLÍNICO PRESENTADO POR LA DRA. M. VICTORIA RAMOS CASADO
- ¿CUÁLES SON LOS PARÁMETROS HEMODINÁMICOS CLÁSICOS? EL DR. JOSÉ MIGUEL ALONSO IÑIGO LOS EXPLICA
- ¿CUÁLES SON LOS PARÁMETROS HEMODINÁMICOS AVANZADOS Y QUÉ INFORMACIÓN APORTAN? EL DR. JOSÉ MIGUEL ALONSO NOS LO EXPLICA
- ¿QUÉ ES UNA ONDA DE PRESIÓN ARTERIAL? EL DR. JOSÉ MIGUEL ALONSO IÑIGO RESPONDE LA PREGUNTA
- 7 INDICADORES DE RESPUESTA AL FLUIDO
- 4 CLAVES PARA UN MAYOR CONTROL EN LA INFUSIÓN DE NORADRENALINA









0 comentarios
Trackbacks/Pingbacks