El Desafío de la Supervivencia y la Farmacología en neonatología
El avance en el cuidado intensivo neonatal ha permitido que recién nacidos con una edad gestacional cada vez menor sobrevivan, a menudo con una necesidad de tratamiento farmacológico intensivo. Sin embargo, esta población es extremadamente vulnerable. La fisiología inmadura del RNPT crea un «punto ciego farmacológico», donde la falta de conocimiento suficiente sobre la maduración de los sistemas enzimáticos y la disposición de los fármacos pone a estos pacientes en riesgo de recibir dosis subóptimas, lo que resulta en efectos adversos o ineficacia del tratamiento.
En consecuencia, la dosificación precisa es esencial para el tratamiento seguro y eficaz de los recién nacidos prematuros. A continuación, analizamos las particularidades que impactan la dosificación, los intervalos, la administración, las precauciones y el riesgo de daño orgánico.
el daño potencial por inmadurez orgánica
La principal causa de la dosificación imprecisa es la inmadurez de los sistemas fisiológicos, que alteran drásticamente la absorción, distribución, metabolismo y excreción (ADME) de los medicamentos, estos principios farmacocinéticos, y determinan la concentración del fármaco en la sangre y tejidos a lo largo del tiempo, permitiendo comprender sus efectos y ajustar las dosis.
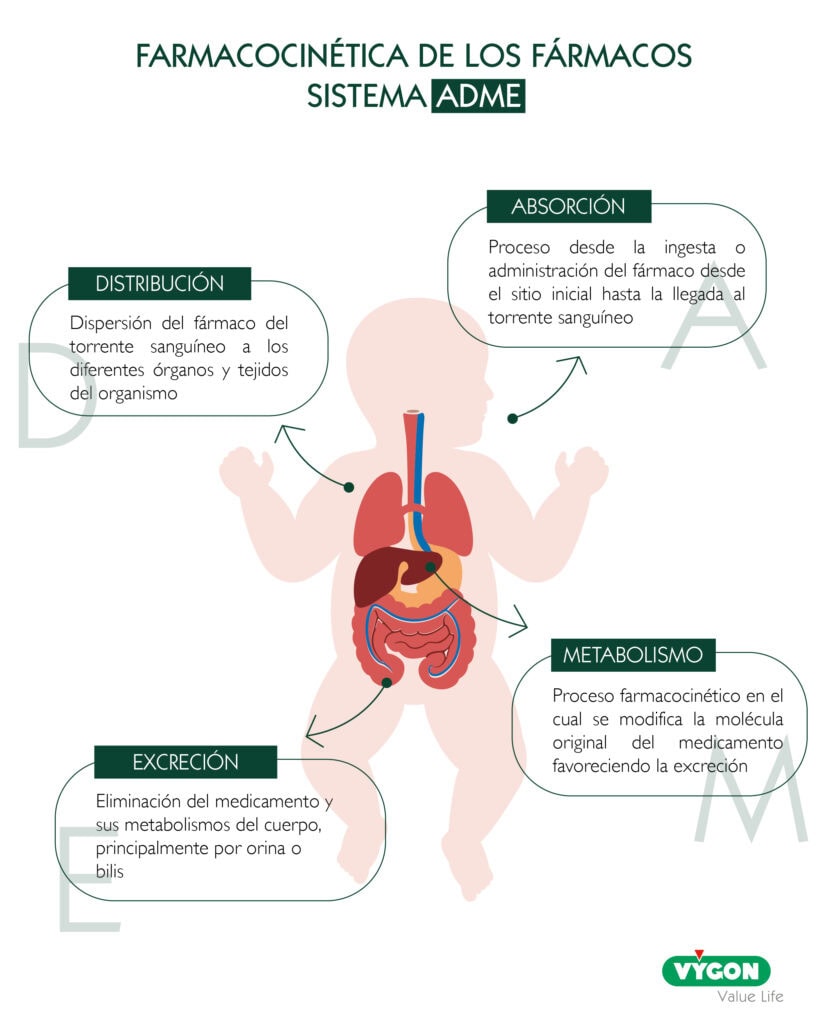
impacto en la distribución y TOXICIDAD sistémica
- Volumen de distribución (Vd) y agua corporal: Los RNPT tienen un mayor porcentaje de agua corporal total (hasta el 85%), lo que aumenta el volumen de distribución de los fármacos hidrosolubles. Esto a menudo requiere una dosis de carga inicial más alta para alcanzar concentraciones terapéuticas efectivas.
- Unión a proteínas: Las concentraciones más bajas de proteínas transportadoras significan que la fracción de fármaco libre y activo en el plasma es mayor. Esto puede causar toxicidad a concentraciones plasmáticas totales que se considerarían seguras en adultos, un fenómeno crítico para fármacos con un estrecho índice terapéutico.
RIESGO DE TOXICIDAD POR INMADUREZ METABÓLICA Y RENAL
- Metabolismo (Hígado): La actividad de las enzimas hepáticas metabolizadoras (Fase I y II) está reducida o inmadura. Esta capacidad metabólica disminuida es responsable de síndromes de toxicidad extrema. Un ejemplo histórico es el Síndrome del Bebé Gris por cloranfenicol (debido a la incapacidad de glucuronoconjugación).
- Excreción (Riñón): La Tasa de Filtración Glomerular (TFG) está significativamente reducida, ralentizando la eliminación de muchos fármacos y aumentando el riesgo de nefrotoxicidad (p. ej., por aminoglucósidos y vancomicina) debido a la acumulación prolongada.
DOSIFICACIÓN, ADMINISTRACIÓN, INTERVALOS Y PRECAUCIONES
Dosificación e Intervalos Ajustados por Maduración
La dosificación debe optimizarse teniendo en cuenta la Edad Gestacional (EG) al nacer y la Edad Postnatal (EPN), ya que ambas influyen en la maduración enzimática y el aclaramiento renal.
- Intervalos extendidos (ejemplo de gentamicina): Los fármacos de eliminación renal requieren intervalos más largos para evitar la acumulación. La gentamicina, por ejemplo, puede requerir intervalos de dosificación de 36 a 48 horas en RNPT para permitir la depuración segura del fármaco.
- Precauciones en vías alternativas: La piel inmadura tiene un estrato córneo más delgado y actúa como un órgano de absorción eficiente, aumentando el riesgo de efectos adversos sistémicos con medicamentos tópicos (por ejemplo, soluciones antisépticas que contienen alcohol).
El Impacto Crítico de la Velocidad de Infusión: El Síndrome del Niño Rojo
Para fármacos administrados por vía intravenosa, la velocidad de infusión es un parámetro de seguridad crucial.
- Precaución con la Vancomicina: El Síndrome del Niño Rojo (Red Man Syndrome) es una reacción adversa aguda causada por la liberación masiva de histamina en respuesta a una infusión intravenosa demasiado rápida. Para prevenir esta reacción, se requiere tecnología de infusión de alta precisión que asegure que la vancomicina se administre a un ritmo no superior a 10mg/min y durante un período mínimo de 60 min. Esto destaca la dependencia de equipos de infusión rigurosos y seguros.
- Es importante destacar el gran reto, primero porque el neonato no es un individuo requerido para estudios y segundo monitorizar la concentración de ciertos fármacos causantes de daño hepático y renal es una consecuencia de anemización. Lo que requiere una estrategia de precisión y propuesta de valor tecnológico
Conoce los de alarma en el neonato: factores de riesgo, patologías y cómo actuar en este artículo
Por consiguiente, para superar los desafíos de la anemia iatrogénica en la práctica neonatal, es fundamental una revolución en la monitorización:
El Desafío de la Anemia Iatrogénica en el TDM
La Monitorización Terapéutica de Fármacos (TDM) es esencial para la individualización de dosis (ajustando el de vancomicina), pero su aplicación choca con el riesgo de anemia iatrogénica debido a las extracciones de sangre repetidas. El volúmen máximo de sangre extraíble es extremadamente limitado en el RNPT, lo que hace que el TDM frecuente sea inviable y obligue a los clínicos a depender de una dosificación empírica menos segura. Esto solo se puede cumplir cuando existe el adecuado manejo de la fisiología de los órganos neonatales y el adecuado uso de las guías farmacológicas neonatales, ya que en ellas se evidencia el estudio de la clearance.
El Aclaramiento como Clave de Seguridad: El Rol de NeoFax y las Guías
El concepto de Aclaramiento (Clearance) define la capacidad de un órgano (hígado o riñón) para eliminar un fármaco. En el RNPT, este aclaramiento es bajo y altamente variable, y se correlaciona directamente con la Edad Gestacional (EG) y la Edad Postnatal (EPN).
- El riesgo de la acumulación: Un aclaramiento lento significa que el fármaco permanece más tiempo en el cuerpo. Si se administra la siguiente dosis antes de que la anterior haya sido eliminada, se produce una acumulación tóxica.
- La solución de las Guías: Las guías farmacológicas, como NeoFax, utilizan la información de los estudios de clearance poblacional en función de la EG y la EPN para establecer el intervalo de dosificación seguro.
- Beneficio directo del cumplimiento: Seguir rigurosamente los intervalos extendidos recomendados (ej., Vancomicina cada 24, 36 o 48 horas) garantiza que la concentración del fármaco caiga a un nivel seguro antes de la siguiente dosis, previniendo directamente la nefrotoxicidad y la ototoxicidad asociadas a la exposición prolongada a niveles altos.
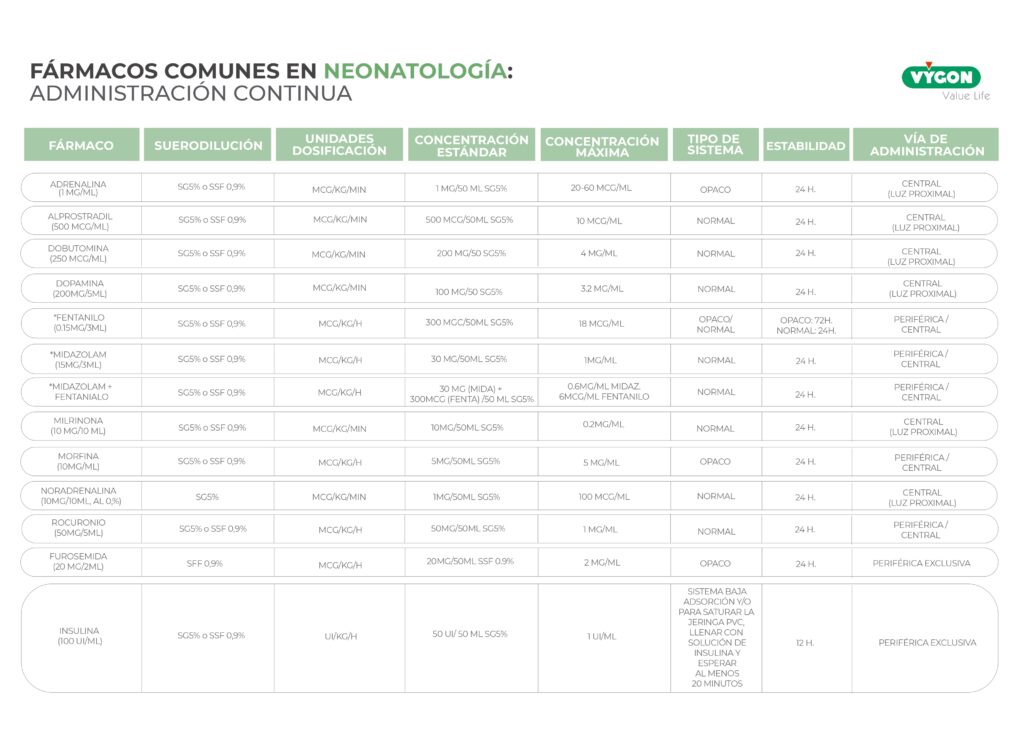
La Solución del Futuro: Monitorización Continua de Fármacos (MCTF)
Inspirado en el éxito de la Monitorización Continua de Glucosa (MCG), proponemos el desarrollo de un Sensor de Monitoreo Continuo de Fármacos (MCTF) para neonatología.
- Objetivo: Obtener un perfil farmacocinético completo y en tiempo real con una mínima o nula extracción de sangre.
- Tecnologías potenciales: Las principales vías de investigación que podrían hacer esto posible incluyen:
- Microdiálisis y biosensores insertables: Dispositivos mínimamente invasivos, que se colocarían en el espacio intersticial o subcutáneo, para tomar muestras de fluidos tisulares y detectar la concentración de fármaco.
- Sensores ópticos no invasivos: Tecnología que utiliza la luz (ej. espectroscopia de infrarrojo cercano o fluorescencia) para detectar la concentración del fármaco directamente a través de la piel.
BENEFICIOS CLAVE DEL MCTF:
- Seguridad hemática: Minimiza el riesgo de anemia y la necesidad de transfusiones.
- Visión de clearance poblacional completa: Ofrece la curva de concentración-tiempo en tiempo real, facilitando el cálculo preciso del AUC (área bajo la curva) y la vida media del fármaco.
- Ajuste dinámico de dosis en neonatología: Permite a las bombas de infusión integrarse con la lectura del sensor para realizar ajustes automáticos e inmediatos de la velocidad de infusión.
La sinergia entre los sistemas de infusión precisa y el Monitoreo Continuo de Fármacos, junto con la correcta elección de dispositivos específicos para el paciente neonatal, es el futuro de la seguridad farmacológica en neonatología, transformando el cuidado de esta población vulnerable.
conclusión
El tratamiento farmacológico del RNPT exige una atención al detalle que solo puede lograrse mediante la comprensión profunda de la farmacología del desarrollo. La inmadurez de los órganos y sistemas enzimáticos, junto con la inviabilidad de la monitorización frecuente, exigen un cambio tecnológico.
En conclusión, la tecnología de infusión de precisión y la propuesta de un Monitoreo Continuo de Fármacos (MCTF) son las claves para garantizar que la precisión sea la norma y no la excepción, protegiendo así a la población de pacientes más vulnerables de la iatrogenia y la subdosificación.
bibliografía
- Mørk ML, Andersen JT, Lausten-Thomsen U, Gade C. The Blind Spot of Pharmacology: A Scoping Review of Drug Metabolism in Prematurely Born Children. Front Pharmacol. 2022 Feb 15;13:828010. doi: 10.3389/fphar.2022.828010. PMID: 35242037; PMCID: PMC8886150.
- Artículos consultados: metabolismo de los fármacos https://pm.amegroups.org/article/view/7227/html






La Lcda rosana Sánchez la mejor en farmacología neonatal
Gracias Lcdo Alexander por sus palabras es un honor pertenecer al mundo neonatal
Saludos Lcdo Alexander, gracias por sus palabras, es una motivación constante y disciplina lo que me mantiene avanzando para dar conocimiento al mundo neonatal
Bueno una cosa es que te apasione la farmacología pero otra de mucho nivel que que nos dejas a quienes hacemos vida en las UCINs un valiosisimo aporte para ejercer con conciencia y responsabilidad, gracias estimada colega Excelente!!
Muchas gracias por la información ..excelente .felicitaciones
Licenciada Rosana , gracias por compartir sus conocimientos, Ud le da el nivel que todo enfermero neonatal debe aspirar
Excelente. Hacia un trato menos invasivo con menos riesgos de complicaciones y mas humanizado hacia estos Recién nacidos tan vulnerables.
Hola Lcda Vilma ese es nuestro reto comprender la fisiopatología del neonato y poder contribuir en la disminución de riesgos y secuelas
Excelente Lcda Rossana, su aporte en la farmacología neonatal es verdaderamente admirable, todo bajo evidencia científica, por el bienestar de nuestros bebés… Muchas Bendiciones y que sigan los frutos.
Gracias Anny, saludos, aqui seguimos investigando para llevar lo mejor y disminuir secuelas generadas por fármacos
Excelente discernimiento ,sobre este gran tema como es la famacologia neonal , y ud lcda Rosana una gran docente para todos nosotros , éxitos
Bien , Sandrita gracias por tu s conocimientos cuyo objetivo es mejorar el cuidado de nuestros pequeños. Exitos y bendiciones
Agradezco infinitamente su aportación Licenciada, en el área de UCIN en México sus aportaciones son oro molido para nuestros prematuros.
El neonato no es un adulto pequeño. La inmadurez renal y hepática modifica la absorción, distribución y eliminación de los fármacos. Por ello, las dosis deben calcularse estrictamente según peso actual, edad gestacional y edad postnatal, respetando dosis e intervalos. GRACIAS ☺️
Muy buenas tardes mi estimada Lcda rossana de antemano quisiera felicitarla por el articulo tan valioso para el mundo neonatal el cual describe de una forma minuciosa cada uno de los efectos, interacion de los farmacos y su metabolizacion al igual me parece un tema de vanguardia en cuanto a las dosis he infusión siempre dejando en alto la parte científica de nuestra profesión.