Contexte
Patrick Bouvier Kennedy, fils de John F. Kennedy ; président des États-Unis, est né le 7 août 1963, cinq semaines et demie avant la date prévue. Après sa naissance, il fût transféré dans l’un des meilleurs hôpitaux pour enfants, le Boston Children’s Hospital, et traité par des spécialistes renommés qui ont notamment utilisé un caisson hyperbare. Malgré tous leurs efforts, Patrick a à peine survécu 39 heures et est décédé le 9 août des suites de la maladie des membranes hyalines (aujourd’hui connue sous le nom de syndrome de détresse respiratoire). Après cette tragédie, John F. Kennedy a débloqué des fonds pour faire avancer la recherche sur les nouveau-nés.
Pour avoir une idée des progrès réalisés en matière de survie néonatale depuis lors : Patrick est né à 34 semaines de gestation, aujourd’hui, un bébé né entre 32 et 34 semaines de gestation a des chances de survie de près de 99 %. (1) Cette petite histoire nous permet d’évaluer les énormes progrès réalisés par la néonatologie en quelques décennies, avec une diminution remarquable des limites de la viabilité et de la prise en charge du patient néonatal et prématuré.
Mais… Qu’est-ce que le syndrome de détresse respiratoire ?
Parmi les pathologies dont l’évaluation et la prise en charge ont évolué, on trouve le syndrome de détresse respiratoire (SDR) du nouveau-né, connu pour être un trouble primaire qui accompagne la prématurité, en particulier l’immaturité pulmonaire et, dans une moindre mesure, des voies respiratoires.
La principale cause du SDR est une quantité insuffisante de surfactant pulmonaire. Le facteur étiologique le plus fréquent est l’accouchement prématuré. Les manifestations de la maladie sont dues à l’atélectasie alvéolaire, à l’œdème et aux lésions cellulaires qui en résultent. En conséquence, les protéines sériques qui inhibent la fonction du surfactant s’infiltrent dans l’alvéole. La teneur en eau plus élevée, les mécanismes immatures d’élimination des liquides pulmonaires, l’absence d’apposition alvéolocapillaire et une surface d’échange gazeuse réduite caractéristique du poumon immature contribuent également à la maladie. La possibilité d’effectuer un diagnostic prénatal pour identifier les nourrissons à risque, la prévention de la maladie par l’administration prénatale de corticostéroïdes, l’amélioration des soins périnatals et néonatals et les progrès en matière d’assistance respiratoire et de thérapie de remplacement du surfactant ont permis de réduire le taux de mortalité causé par le SDR.
Connaître les clés de la prise en charge des nouveau-nés atteints de SDR
Comme mentionné ci-dessus, le principal progrès dans la prise en charge des nouveau-nés repose sur l’amélioration des traitements et des soins. C’est pourquoi nous ne devons pas oublier les clés du traitement des bébés atteints de SDR, à savoir :
- Prévenir l’hypoxémie et l’acidose (en permettant un métabolisme tissulaire normal, en optimisant la production de surfactant et en évitant l’apparition de shunts droite-gauche).
- Optimiser le contrôle des fluides (pour éviter, d’un côté, l’hypovolémie et le choc, et de l’autre, les œdèmes, en particulier l’œdème pulmonaire).
- Diminuer les besoins métaboliques
- Éviter l’aggravation de l’atélectasie et de l’œdème pulmonaire ; (v) minimiser les lésions pulmonaires oxydatives
- Diminuer les lésions pulmonaires causées par la ventilation mécanique.
Malgré cela, le SDR reste une cause importante de mortalité et de morbidité néonatales, en particulier chez les nouveau-nés les plus prématurés (2).
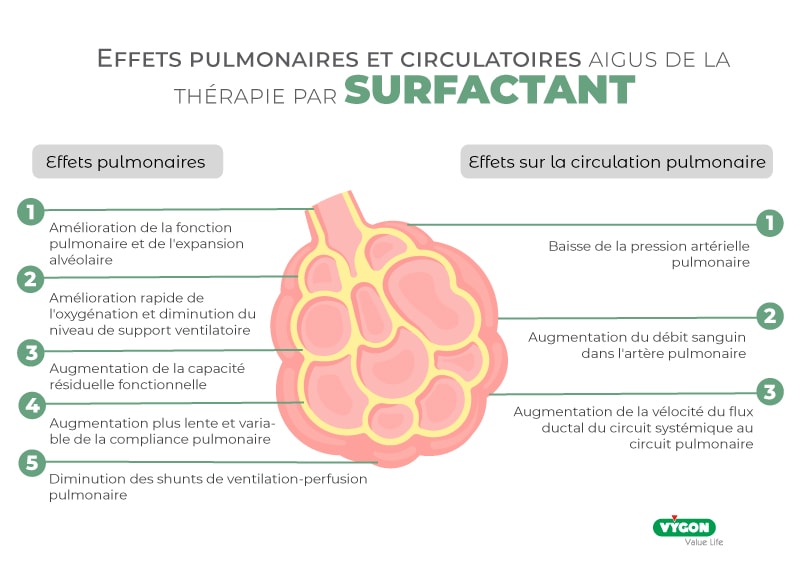
Comme mentionné précédemment, l’un des facteurs déclencheurs les plus importants (si ce n’est le plus important) dans l’étiologie du SDR est la prématurité. En général, l’incidence et la gravité du SDR sont inversement proportionnelles à l’âge gestationnel (plus l’âge gestationnel est bas, plus le risque de SDR est élevé) (3) :

Quelles sont les pathologies couvertes par la physiopathologie du SDR ?
Pour comprendre une pathologie et pouvoir mettre en relation ses manifestations et l’origine de ses fondements, la connaissance de la physiopathologie est essentielle, ce qui pour le SDR comprend : (3)
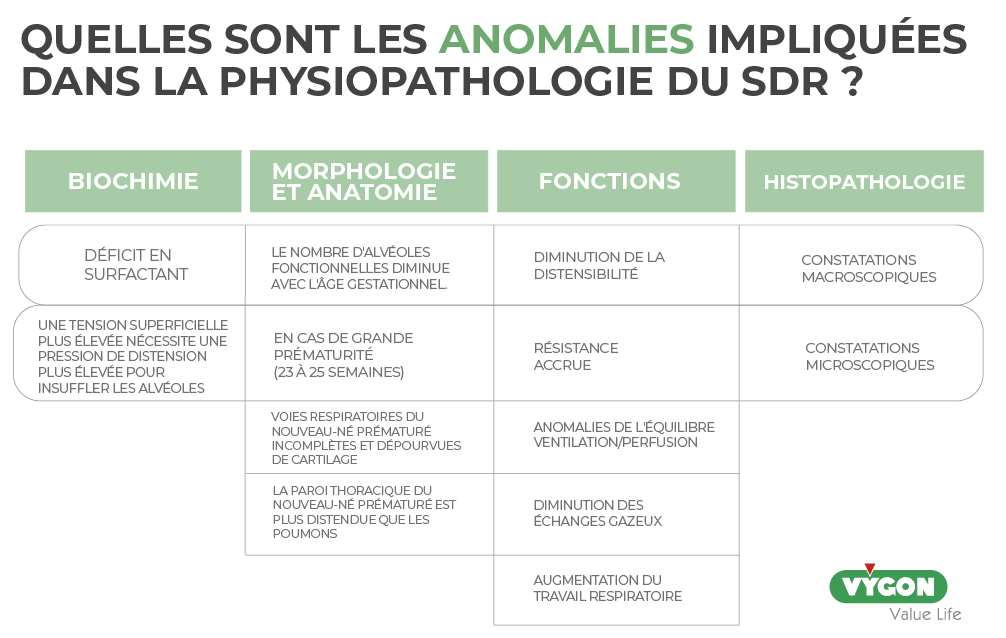
Anomalies biochimiques
a) La principale caractéristique est une carence en surfactant, qui entraîne une augmentation de la tension au niveau de la surface alvéolaire et interfère avec les échanges gazeux normaux.
b) Selon la loi de Laplace, une tension superficielle plus élevée nécessite une pression de distension plus élevée pour insuffler les alvéoles :

A mesure que le rayon de l’alvéole diminue (atélectasie) et que sa tension superficielle augmente, la pression nécessaire pour surmonter ces forces augmente.
Anomalies morphologiques et anatomiques
- Le nombre d’alvéoles fonctionnelles augmente avec l’âge gestationnel. Un bébé prématuré aura donc une plus petite surface d’échange gazeux.
- En cas de prématurité extrême (23 à 25 semaines), la distance entre l’alvéole ou la bronchiole terminale et le capillaire adjacent le plus proche augmente, ce qui accroît la barrière de diffusion, qui entrave le transport de l’oxygène des poumons vers le sang.
- Les voies respiratoires du nouveau-né prématuré sont incomplètement formées et n’ont pas suffisamment de cartilage pour rester perméables. Il peut en résulter un collapsus et une résistance accrue des voies aériennes.
- La paroi thoracique du nouveau-né prématuré est plus distensible que les poumons et a donc tendance à s’affaisser lorsque le nouveau-né tente d’augmenter la pression négative intrathoracique et d’accroître le travail respiratoire.
Anomalies fonctionnelles
- Diminution de la distensibilité
- Augmentation de la résistance
- Équilibre ventilation/perfusion anormal
- Diminution des échanges gazeux
- Augmentation du travail respiratoire
Anomalies histopathologiques
- Les autopsies de nouveau-nés décédés du SDR révèlent un poumon presque uniformément dépourvu d’air. L’examen microscopique révèle une atélectasie diffuse entourant quelques bronchioles terminales et des canaux alvéolaires fortement dilatés. Une membrane éosinophile fibrineuse (ou membrane hyaline) contenant des débris cellulaires dérivés du sang et de l’épithélium lésé tapisse ces espaces aériens. Cette observation post-mortem courante a permis d’établir la nomenclature initiale du SDR en tant que maladie des membranes hyalines (4).
- Résultats macroscopiques :
- Diminution de la ventilation.
- Poumons rigides, caoutchouteux, ressemblant à un foie.
- Diminution des volumes pulmonaires.
- Diminution de la ventilation.
- Résultats microscopiques :
- Espaces aériens remplis d’un exsudat cosinophile composé de matières protéiques, avec ou sans cellules inflammatoires.
- Œdème dans les espaces aériens.
- Collapsus alvéolaire.
- Métaplasie squameuse de l’épithélium respiratoire.
- Distension des vaisseaux lymphatiques.
- Épaississement des artérioles pulmonaires.
Bien que le diagnostic définitif du SDR nécessite une documentation pathologique ou biochimique de la déficience en surfactant, les cliniciens utilisent généralement une combinaison de caractéristiques cliniques et radiographiques pour diagnostiquer le SDR.
Quelles sont les manifestations cliniques du SDR ?
Les symptômes cliniques se manifestent peu après la naissance et comprennent :
- Une respiration sifflante
- Tachypnée : le nouveau-né atteint de SDR respire rapidement pour tenter de compenser les faibles volumes courants en augmentant la fréquence respiratoire et la ventilation minute afin d’éliminer le dioxyde de carbone.
- L’évasement nasal : il augmente le passage transversal des voies nasales et diminue la résistance des voies aériennes supérieures.
- Gémissement : il s’agit d’une tentative du nouveau-né de produire une pression positive en fin d’expiration (PEEP) en expirant contre la glotte fermée. Le but est de maintenir un certain volume alvéolaire (distension) afin que le rayon des alvéoles soit plus grand et que le travail nécessaire à leur expansion soit moindre.
- Rétractions : Le nouveau-né utilise des muscles respiratoires accessoires, tels que les muscles intercostaux, pour fournir la pression accrue nécessaire à l’insufflation des poumons.
- Cyanose : Elle reflète une diminution de l’oxygénation, lorsque le taux d’hémoglobine désoxygénée est supérieur à 5g/dI.
Dans les cas graves de SDR, les nouveau-nés peuvent évoluer vers une insuffisance respiratoire nécessitant une intubation et une ventilation mécanique (4).
Littérature
- Ancel PY, Goffinet F ; EPIPAGE-2 Writing Group ; et al. Survival and morbidity of preterm children born at 22 through 34 weeks’ gestation in France in 2011 : results of the EPIPAGE-2 cohort study (Survie et morbidité des enfants prématurés nés entre 22 et 34 semaines de gestation en France en 2011 : résultats de l’étude de cohorte EPIPAGE-2). JAMA Pediatr. 2015.
- John P. Cloherty, Eric C. Eichenwald, Anne R. Hansen, Ann R. Stark. Manuel de néonatologie. 7ª edición. España. Wolters Kluwer España, S.A., Lippincott Williams&Wilkins. 2012.
- Yadav S, Lee B, Kamity R. Syndrome de détresse respiratoire néonatale. 2023 25 juillet. StatPearls Publishing ; 2024 Jan.
- Christopher McPherson, Jennifer A. Wambach. Neonatal Network. Vol 37. Nº 3. Prévention et traitement du syndrome de détresse respiratoire chez les nouveau-nés prématurés. Springer Publishing Company. 2018.