La hipovolemia juega un papel importante en el shock séptico y su gestión óptima es esencial para la recuperación de los pacientes.
¿QUÉ ENCONTRARÁS EN ESTE ARTÍCULO?
- Hipovolemia en el shock séptico
- ¿Cuál es la causa de hipovolemia en el paciente séptico?
- Pérdida de volumen gastrointestinal, taquipnea, sudoración y disminución de la ingesta de líquidos.
- Fuga capilar.
- Alteraciones de la coagulación y la fibrinólisis.
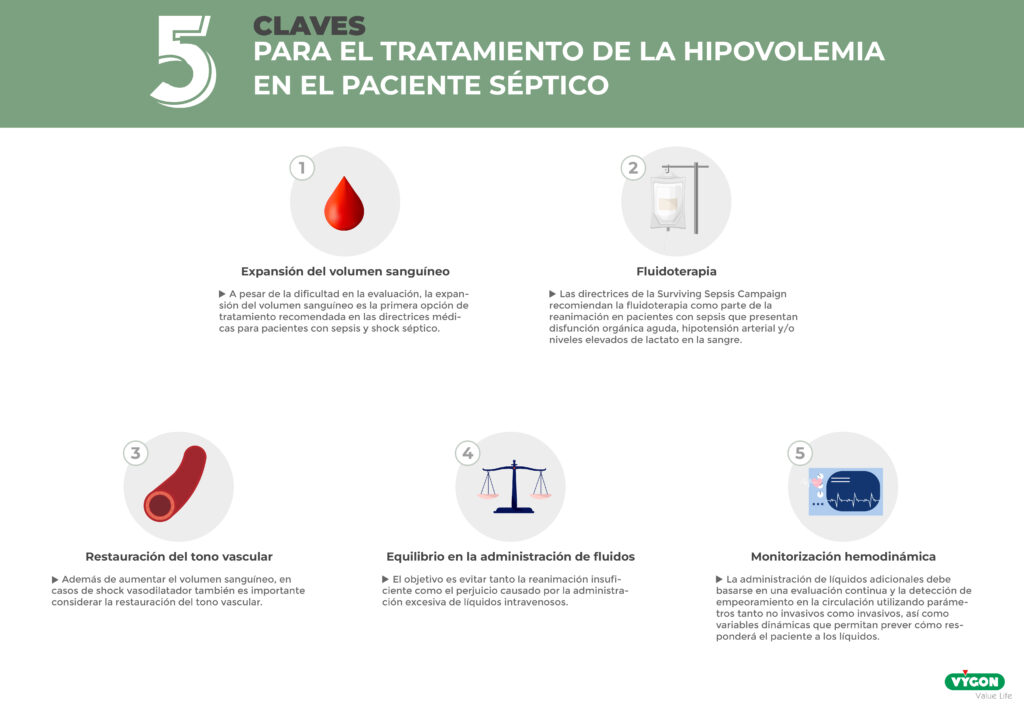
- 5 Claves para el tratamiento de la hipovolemia en el paciente séptico
- Expansión del volumen sanguíneo
- Fluidoterapia
- Restauración del tono vascular
- Equilibrio en la administración de fluidos
- Monitorización hemodinámica
- ¿Qué fluido administrar?
¿Quieres saber más sobre el tratamiento de la hipovolemia en el paciente séptico? Permanece en esta página y lee la entrada completa.
La sepsis afecta a más de 19 millones de personas anualmente, de las cuales 6 millones no sobrevivirán y aproximadamente 3 millones desarrollarán trastornos cognitivos y funcionales.1
Son diversos los factores que nos conducen a estos terribles resultados, entre los que se incluye comorbilidad previa, gravedad de la enfermedad aguda, identificación oportuna, así como las intervenciones realizadas. 1
En este contexto, la hipovolemia juega un papel importante en el shock séptico y su gestión óptima es esencial para la recuperación de los pacientes. 1
Hipovolemia en el shock séptico
En críticos, la hipovolemia, es una condición frecuente. Tanto la hipovolemia absoluta, caracterizada por la pérdida de volumen sanguíneo, como la hipovolemia relativa, derivada de la redistribución del volumen sanguíneo, son fenómenos recurrentes en las unidades de cuidados intensivos. De esta condición no se escapan los pacientes sépticos. 1
En estos casos, la redistribución del volumen sanguíneo emerge como el motor subyacente de la hipovolemia. Para asegurar la recuperación y supervivencia de los pacientes, es imprescindible comprender en profundidad este fenómeno. 1
¿Quieres saber más sobre la hipovolemia? Lee este artículo:
¿Cuál es la causa de hipovolemia en el paciente séptico?
La sepsis produce hipovolemia, y la hipovolemia contribuye de manera significativa al deterioro que desencadena el estado de shock séptico.2
La hipovolemia en el shock séptico tiene tres causas principales:
- Pérdida de volumen gastrointestinal, taquipnea, sudoración y disminución de la ingesta de líquidos. 2
- Fuga capilar. 2
- Alteraciones de la coagulación y la fibrinólisis. 2
1. Pérdida de volumen gastrointestinal, taquipnea, sudoración y disminución de la ingesta de líquidos
En primer lugar, está la pérdida de volumen gastrointestinal, que puede resultar de síntomas como diarrea y vómitos, a menudo presentes en pacientes con sepsis. Además, la taquipnea, la sudoración excesiva y la reducción de la ingesta de líquidos durante el curso de la enfermedad también contribuyen a este desequilibrio. 2
2. Fuga capilar
La segunda causa de hipovolemia en el shock séptico proviene de un proceso insidioso: la fuga capilar. En este escenario, las moléculas de adhesión al endotelio vascular y a las células circulantes (plaquetas, leucocito polimorfonuclear y monocitos) se manifiestan mediante una reacción inflamatoria. 2
Los leucocitos activados se adhieren al endotelio vascular y migran a los tejidos subendoteliales. Las alteraciones en las uniones endoteliales intercelulares dan como resultado un aumento de la permeabilidad capilar y edema generalizado. 2
3. Alteraciones de la coagulación y la fibrinólisis
Las alteraciones de la coagulación y la fibrinólisis completan el cuadro, y los mediadores proinflamatorios crean un estado procoagulante. La activación del factor tisular en diversas células, especialmente en monocitos y células endoteliales, desencadena el sistema de coagulación. La endotoxina, el TNF-α y la IL-1 actúan como mediadores clave en este proceso.2
En pacientes sépticos nos encontramos con un problema añadido, los niveles plasmáticos de anticoagulantes naturales como la proteína C, la proteína S y la antitrombina disminuyen considerablemente debido a la reducción en su síntesis y al aumento en su consumo y eliminación. 2
En la etapa temprana de la sepsis, también se estimula la trombólisis, lo que resulta en un aumento en los niveles del inhibidor del activador del plasminógeno-1 (PAI-1). Esto, en última instancia, inclina el equilibrio hacia los procesos procoagulantes, a menudo desencadenando una coagulación intravascular diseminada y contribuyendo al trastorno microcirculatorio que desencadena la disfunción orgánica múltiple. 2
Todo ello conlleva al agotamiento de los factores de coagulación y la supresión del sistema fibrinolítico en la sepsis tardía, lo que promueve aún más la fuga capilar, el sangrado y la redistribución de líquidos hacia el tercer espacio, un proceso complejo y perjudicial que desempeña un papel fundamental en la evolución de esta afección. 2
5 Claves para el tratamiento de la hipovolemia en el paciente séptico
Evaluar el grado de hipovolemia es un desafío debido a la complejidad de los casos, la fisiopatología subyacente y la falta de marcadores clínicos confiables en muchos de los casos.
No obstante, las directrices y estudios médicos señalan algunas recomendaciones que deberíamos tener en cuenta al enfrentarnos a estos pacientes:
- Expansión del volumen sanguíneo. A pesar de la dificultad en la evaluación, la expansión del volumen sanguíneo es la primera opción de tratamiento recomendada en las directrices médicas para pacientes con sepsis y shock séptico.1
- Fluidoterapia. Las directrices de la Surviving Sepsis Campaign (SSC) recomiendan la fluidoterapia como parte de la reanimación en pacientes con sepsis que presentan disfunción orgánica aguda, hipotensión arterial y/o niveles elevados de lactato en la sangre.
- Restauración del tono vascular. Además de aumentar el volumen sanguíneo, en casos de shock vasodilatador también es importante considerar la restauración del tono vascular. 1
- Equilibrio en la administración de fluidos. El tratamiento de pacientes con sepsis e hipovolemia supone todo un reto ya que deben es de vital importancia encontrar un equilibrio entre administrar líquidos suficientes, sin llegar a una sobrecarga de fluidos. El objetivo es evitar tanto la reanimación insuficiente como el perjuicio causado por la administración excesiva de líquidos intravenosos. 1
- Monitorización hemodinámica. La administración de líquidos adicionales debe basarse en una evaluación continua y la detección de empeoramiento en la circulación utilizando parámetros tanto no invasivos como invasivos, así como variables dinámicas que permitan prever cómo responderá el paciente a los líquidos.
¿Qué fluido administrar?
La fluidoterapia en pacientes con sepsis e hipovolemia es todo un reto incluso para profesional más experimentado. Conseguir el equilibrio adecuado entre una reanimación insuficiente o excesiva y entre el beneficio y el perjuicio de los líquidos intravenosos, así como otras soluciones administradas para el shock marcará la diferencia entre un pronóstico favorable o, incluso, la pérdida del paciente.1
Riesgos fluidoterapia en el paciente séptico con hipovolemia
El riesgo de que perjudiquemos a nuestros pacientes con la terapia de fluidos es alto, esto se debe a:
- Alta toxicidad de las soluciones coloides sintéticas. 1
- Posible afectación renal con solución salina isotónica. 1
- Creciente evidencia de afectación multiorgánica asociada a la sobrecarga de fluidos en pacientes con sepsis. 1
Cristaloides y coloides
Tradicionalmente, se creía que las soluciones coloides tenían una capacidad de expansión del volumen plasmático significativamente superior a la de las soluciones cristaloides. 1
No obstante, un análisis sistemático reciente sugirió un aumento modesto en la eficacia de los coloides en este aspecto específico, aunque se observó una variabilidad considerable y en su mayoría inexplicable entre los estudios. A pesar de ello, si parece haber consenso entre estos con respecto a que la eficacia de los coloides parece haber disminuido con el tiempo. 1
Actualmente, se utilizan más soluciones cristaloides que hace una década y, entre ellas, se emplean más soluciones tamponadas y menos suero salino. Y, por tanto, se utilizan menos soluciones coloides, en particular las sintéticas como el hidroxietilalmidón, la gelatina y el dextrano. Por su parte, el uso de albúmina está en aumento. 1
En cuanto a la elección del líquido para la expansión del volumen, en volúmenes muy grandes, la solución salina isotónica puede inducir a acidosis hiperclorémica, por lo que se debe tener precaución en su administración. 4
La expansión de volumen inicial deberá estar adaptada al paciente. Para ello, se deberá tener en cuenta el peso, pero, para un tratamiento óptimo, también deberemos evaluar la posible hipovolemia absoluta inducida por la pérdida de líquidos. 4
¿Qué dicen las guías?
Este cambio hacia el uso de soluciones cristaloides por encima de coloides han sido impulsados por la evidencia derivada de ensayos clínicos controlados aleatorizados y revisiones sistemáticas que han arrojado luz sobre los efectos adversos del hidroxietilalmidón en pacientes críticos, incluyendo aquellos que sufren sepsis. 1
A la publicación de estos ensayos se sumó la Surviving Sepsis Campaign, quienes lo incluyeron entre sus recomendaciones. Por su parte, la Agencia Europea de Medicamentos (EMA) y la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) también lo incluyo en sus directrices sobre el almidón. 1
Por otra parte, el equilibrio entre los beneficios y los perjuicios de la albúmina y la gelatina es menos claro. No obstante, la campaña sobrevivir a la sepsis sugiere: 1
- Uso de albúmina en pacientes que requieren cantidades importantes de cristaloides. 1
- Utilizar cristaloides en lugar de gelatina. 1
Vasopresores y vasodilatadores
En el shock séptico, la hipotensión es un signo característico, por ello, habitualmente en el tratamiento de estos pacientes se incluyen vasoconstrictores y, en particular, norepinefrina. 1
Aunque aún no se ha establecido con certeza cuándo se debe iniciar la infusión de norepinefrina en el tratamiento del shock séptico, es importante destacar que un inicio temprano puede resultar beneficioso al aumentar la presión arterial, el retorno venoso y el gasto cardíaco, incluso en pacientes con hipovolemia. 1
Por otro lado, los corticosteroides también pueden ser capaces de elevar la presión arterial en pacientes con shock séptico, probablemente mediante la reducción general de la vasoplejía. 1
En esta misma línea, la utilización de agentes con potencial vasodilatador, como el propofol, podría agravar el estado de hipovolemia, aumentando la dependencia de la precarga, en pacientes con shock séptico. 1

Monitorización hemodinámica
La descompensación hemodinámica en la sepsis plantea un complejo escenario donde convergen factores como el tono vascular anormal, la hipovolemia y la disfunción miocárdica. La peculiaridad de esta situación radica en que cualquiera de estos elementos puede asumir un papel predominante en la presentación inicial, y su importancia relativa puede cambiar a lo largo del tiempo. Su complejidad hace que el examen físico no siempre sea suficiente.3
Para tomar decisiones terapéuticas, como la administración de líquidos, inotrópicos o vasopresores, siempre que sea posible, deberemos acudir a medios de diagnóstico y evaluación más precisos.3
En este contexto, nos encontramos con los monitores de gasto cardíaco, los cuales pueden aportarnos información precisa del estado hemodinámico del paciente, lo cual nos permitirá individualizar la terapia y, por tanto, mejorar el pronóstico de nuestros pacientes.
¿Quieres saber más sobre monitorización hemodinámica en el paciente séptico? Lee este artículo:
Ante pacientes tan complejos, en los que los cambios hemodinámicos pueden presentarse de un momento a otro, es importante contar con sistemas de monitorización que nos muestren parámetros clave a tiempo real y que nos permitan observar una tendencia. Entre los monitores que nos aportan esta inmediatez y un amplio número de parámetros hemodinámicos, unido a una alta precisión con mínima invasividad, encontramos el método P.R.A.M.
¿Qué monitor hemodinámico elegir? Lee este artículo:
La administración de fluidos es, en muchos casos, indispensable en el tratamiento de los pacientes en sepsis o shock séptico, no obstante, no está exenta de riesgos. Entre las posibles complicaciones encontramos: toxicidad de ciertas soluciones coloides sintéticas, posibles problemas renales con solución salina isotónica y evidencia de afectación multiorgánica debido a la sobrecarga de fluidos. 2
El empleo de monitorización hemodinámica nos permitirá tener un mayor control sobre los fluidos y evitar infusiones excesivas o suficientes, así como adelantarnos a posibles complicaciones que puedan poner en riesgo la vida del paciente.
Bibliografía
- Perner, A., Cecconi, M., Cronhjort, M. et al. Expert statement for the management of hypovolemia in sepsis. Intensive Care Med 44, 791–798 (2018). https://doi.org/10.1007/s00134-018-5177-x
- Kim K, Choi HS, Chung SP, Kwon WY. Septic Shock. Essentials of Shock Management. 2018 Aug 3:55–79. doi: 10.1007/978-981-10-5406-8_5. PMCID: PMC7121676.
- Ranjit S, Aram G, Kissoon N, Ali MK, Natraj R, Shresti S, Jayakumar I, Gandhi D. Multimodal monitoring for hemodynamic categorization and management of pediatric septic shock: a pilot observational study*. Pediatr Crit Care Med. 2014 Jan;15(1):e17-26. doi: 10.1097/PCC.0b013e3182a5589c. PMID: 24196006.
- Monnet X, Lai C, Teboul JL. How I personalize fluid therapy in septic shock? Crit Care. 2023 Mar 24;27(1):123. doi: 10.1186/s13054-023-04363-3. PMID: 36964573; PMCID: PMC10039545.
- Montomoli J, Donati A, Ince C. Acute Kidney Injury and Fluid Resuscitation in Septic Patients: Are We Protecting the Kidney? Nephron. 2019;143(3):170-173. doi: 10.1159/000501748. Epub 2019 Aug 8. PMID: 31394531; PMCID: PMC6878740.
- Kron S, Leimbach T, Wenkel R, Thieme U, Kern H, Kron J. Relative Blood Volume Monitoring during Renal Replacement Therapy in Critically Ill Patients with Septic Shock: A Preliminary Report. Blood Purif. 2015;40(2):133-8. doi: 10.1159/000433415. PMID: 26184112.
- Ruokonen E, Parviainen I, Uusaro A. Treatment of impaired perfusion in septic shock. Ann Med. 2002;34(7-8):590-7. doi: 10.1080/078538902321117814. PMID: 12553499.
- Sharawy N, Lehmann C. New directions for sepsis and septic shock research. J Surg Res. 2015 Apr;194(2):520-527. doi: 10.1016/j.jss.2014.12.014. Epub 2014 Dec 10. PMID: 25596653.
- Seymour CW, Rosengart MR. Septic Shock: Advances in Diagnosis and Treatment. JAMA. 2015 Aug 18;314(7):708-17. doi: 10.1001/jama.2015.7885. Erratum in: JAMA. 2015 Oct 6;314(13):1404. PMID: 26284722; PMCID: PMC4646706.
- Kislitsina ON, Rich JD, Wilcox JE, Pham DT, Churyla A, Vorovich EB, Ghafourian K, Yancy CW. Shock – Classification and Pathophysiological Principles of Therapeutics. Curr Cardiol Rev. 2019;15(2):102-113. doi: 10.2174/1573403X15666181212125024. PMID: 30543176; PMCID: PMC6520577.
- Russell JA, Rush B, Boyd J. Pathophysiology of Septic Shock. Crit Care Clin. 2018 Jan;34(1):43-61. doi: 10.1016/j.ccc.2017.08.005. PMID: 29149941.
- Dellinger RP, Levy MM, Rhodes A, Annane D, Gerlach H, Opal SM, Sevransky JE, Sprung CL, Douglas IS, Jaeschke R, Osborn TM, Nunnally ME, Townsend SR, Reinhart K, Kleinpell RM, Angus DC, Deutschman CS, Machado FR, Rubenfeld GD, Webb SA, Beale RJ, Vincent JL, Moreno R; Surviving Sepsis Campaign Guidelines Committee including the Pediatric Subgroup. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012. Crit Care Med. 2013 Feb;41(2):580-637. doi: 10.1097/CCM.0b013e31827e83af. PMID: 23353941.
- Seymour CW, Rosengart MR. Septic Shock: Advances in Diagnosis and Treatment. JAMA. 2015 Aug 18;314(7):708-17. doi: 10.1001/jama.2015.7885. Erratum in: JAMA. 2015 Oct 6;314(13):1404. PMID: 26284722; PMCID: PMC4646706.
- Khorsand S, Helou MF, Satyapriya V, Kopanczyk R, Khanna AK. Not all Shock States Are Created Equal: A Review of the Diagnosis and Management of Septic, Hypovolemic, Cardiogenic, Obstructive, and Distributive Shock. Anesthesiol Clin. 2023 Mar;41(1):1-25. doi: 10.1016/j.anclin.2022.11.002. PMID: 36871993.
- Kattan E, Castro R, Vera M, Hernández G. Optimal target in septic shock resuscitation. Ann Transl Med. 2020 Jun;8(12):789. doi: 10.21037/atm-20-1120. PMID: 32647714; PMCID: PMC7333135.
- Jasiński T, Stefaniak J. COVID-19 and haemodynamic failure: a point of view on mechanisms and treatment. Anaesthesiol Intensive Ther. 2020;52(5):409-417. doi: 10.5114/ait.2020.101813. PMID: 33327700; PMCID: PMC10183984.
- Schumer W. Pathophysiology and treatment of septic shock. Am J Emerg Med. 1984 Jan;2(1):74-7. doi: 10.1016/0735-6757(84)90112-8. PMID: 6517987.



Excelente información!!!