Dans les zones de soins aigus, où les patients peuvent être hémodynamiquement instables (ou à risque d’instabilité), les cliniciens cherchent à optimiser la perfusion afin d’éviter le dysfonctionnement des organes, la défaillance de plusieurs organes, voire le décès. Ces zones font référence aux unités de soins intensifs, aux zones périopératoires et à d’autres endroits où des dérèglements circulatoires peuvent se produire.
En général, lorsque la perfusion devient importante, la pression artérielle (PA), en particulier la pression artérielle moyenne (PAM), est considérée comme un substitut hémodynamique clé pour l’apport d’oxygène, l’hypotension étant la préoccupation clinique, car elle est associée à une détérioration de l’état des patients. Cependant, on sait aujourd’hui que l’hypotension ne conduit pas strictement à une hypoperfusion des organes et qu’elle a des mécanismes physiopathologiques sous-jacents hétérogènes (Meng, 2021).
Si l’on décompose le concept clinique de la PAA, ses deux déterminants sont le débit cardiaque (DC) et la résistance vasculaire systémique (RVS). L’hétérogénéité sous-jacente à l’hypotension est liée aux changements potentiels des deux déterminants de la PAA, et l’action thérapeutique dans chaque scénario possible sera différente.
La littérature montre de plus en plus que le CO n’est pas seulement un déterminant de la PAA, mais qu’il est également en corrélation étroite et indépendante avec la perfusion organique, ce qui enrichit la vision traditionnelle de la perfusion résultant de la pression de perfusion divisée par les résistances vasculaires régionales. Le CO est finalement fourni à divers tissus et organes et la somme de leurs parts de perfusion correspond au CO (Meng, 2021).
Le CO est déterminé par les besoins métaboliques individuels et varie d’un individu à l’autre. Il n’existe donc pas de référence de CO adaptée à tous les patients. Bien que la PEA et le CO soient physiologiquement liés, il n’existe aucune preuve d’une corrélation importante entre la pression artérielle et le CO chez les patients subissant des interventions chirurgicales, par exemple. Les données sur la prise en charge périopératoire guidée par le CO suggèrent que la prise en charge guidée par le CO peut réduire les complications postopératoires et la mortalité, tout en soulignant la nécessité de mener d’autres études, plus robustes (Kouz et al., 2024).
En monitorant le CO et ses déterminants (précharge, fréquence cardiaque, postcharge et contractilité), il est possible de bénéficier d’une orientation et d’un soutien supplémentaires au cours des différentes étapes thérapeutiques, telles que les diagnostics différentiels (par exemple, les mécanismes de choc), le traitement et la réponse, ainsi que l’évaluation continue (Huygh et al., 2016). Grâce à des valeurs hémodynamiques plus avancées, il est possible d’identifier simplement les besoins réels du patient, qu’il s’agisse de réanimation liquidienne, de vasopresseurs, d’agents chronotropes ou inotropes, ce qui peut améliorer les résultats pour le patient en agissant de manière plus proactive et personnalisée.
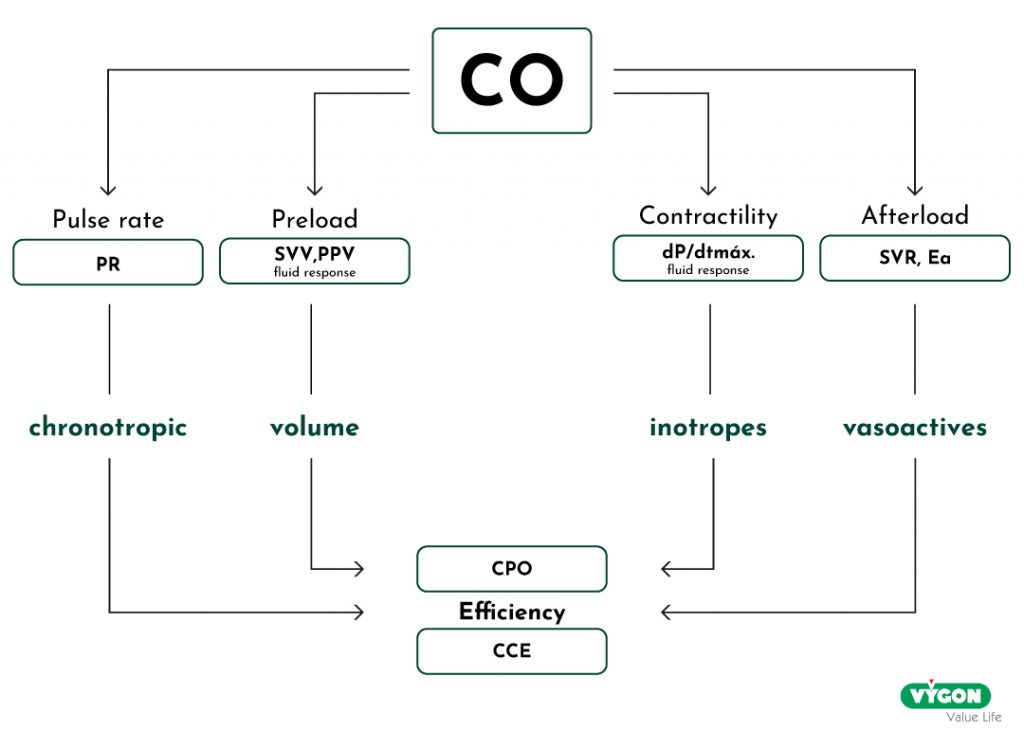
Plusieurs méthodes sont disponibles pour la surveillance du CO, notamment la thermodilution de l’artère pulmonaire ou transpulmonaire, l’analyse de l’onde de pouls, le Doppler œsophagien et les techniques de bioréactance. Le choix de la technologie dépendra principalement de son applicabilité clinique, mais aussi de l’expertise et de l’approche de l’utilisateur. Despite the choice of monitoring method, a basic physiologic and pathophysiologic understanding of relevant haemodynamic variables remains essential (Kouz et al., 2024).
Par ailleurs, dans l’idéal, la technologie de monitorage du CO devrait être fiable, continue, non invasive, indépendante de l’opérateur, rentable et permettre une réaction rapide. Les dispositifs de monitorage du CO devraient progressivement être interconnectés avec d’autres types de solutions de monitorage. La durabilité environnementale associée à ces dispositifs est également de plus en plus prise en compte (de Waal et al., 2009 ; Kouz et al., 2024).
BIBLIOGRAPHIE
- de Waal, Eric ECa et al. (2009). Cardiac output monitoring. Current Opinion in Anaesthesiology 22(1): p71-77. doi: 10.1097/ACO.0b013e32831f44d0
- Huygh, J. et al. (2016). Hemodynamic monitoring in the critically ill: an overview of current cardiac output monitoring methods [version 1; referees: 3 approved] F1000Research 5(F1000 Faculty Rev):2855. doi: 10.12688/f1000research.8991.1
- Kouz, K. et al. (2024). Haemodynamic monitoring during noncardiac surgery: past, present, and future. Journal of Clinical Monitoring and Computing (2024) 38:565–580. doi: 10.1007/s10877-024-01161-2.
- Meng, L. (2021). Heterogeneous impact of hypotension on organ perfusion and outcomes: a narrative review. British Journal of Anaesthesia, vol. 127, Issue 6, 845 – 86. doi: 10.1016/j.bja.2021.06.048