La gestione emodinamica avanzata del paziente con malattia critica, come nel caso del paziente settico, rappresenta un ambito di interesse particolare ed affascinante della medicina intensiva. I trials clinici, volti ad individuare target standardizzati per il trattamento di alterazioni emodinamiche specifiche ai comuni stati patologici di shock di varia natura, sono stati fallimentari.
Risulta chiara la necessità di un management emodinamico tailored, individualizzato, adattabile all’evoluzione clinica e allo stato anamnestico.
La necessaria somministrazione di fluidi, vasoattivi e inotropi è indispensabile per il mantenimento della perfusione periferica d’organo negli stati di shock, tuttavia emerge forte il concetto che tali strumenti terapeutici essenziali presentano un lato oscuro ed effetti potenzialmente negativi sull’outcome.
L’IMPORTANZA DELLA GESTIONE DELLA VOLEMIA
La gestione della volemia è uno degli argomenti più dibattuti e studiati in terapia intensiva. E’ ormai acclarato che l’intervallo terapeutico volto al mantenimento dello stato euvolemico dipende da numerosi fattori e diventa molto stretto con il facile rischio di incrementare l’edema tissutale, deteriorare la funzione d’organo (insufficienza cardiaca, insufficienza renale, edema polmonare, etc..) e peggiorare la prognosi dei pazienti.
L’individuazione di indici di fluid responsiveness dinamici (Pulse Pressure Variation, Stroke Volume Variation, Elastanza Dinamica) costituiscono un primo approccio ragionato alla gestione di fluidi e vasoattivi nel paziente critico. In particolare, l’oscillazione volemica indotta dalla variazione respiratoria della pressione intratoracica durante ventilazione meccanica, determina una variazione della pulse pressure e dello stroke volume nell’atto respiratorio.
Maggiore è la variazione percentuale di questi indici, più alta è la probabilità di ottenere un incremento della portata cardiaca e/o dello stroke volume index dopo riempimento fluidico.
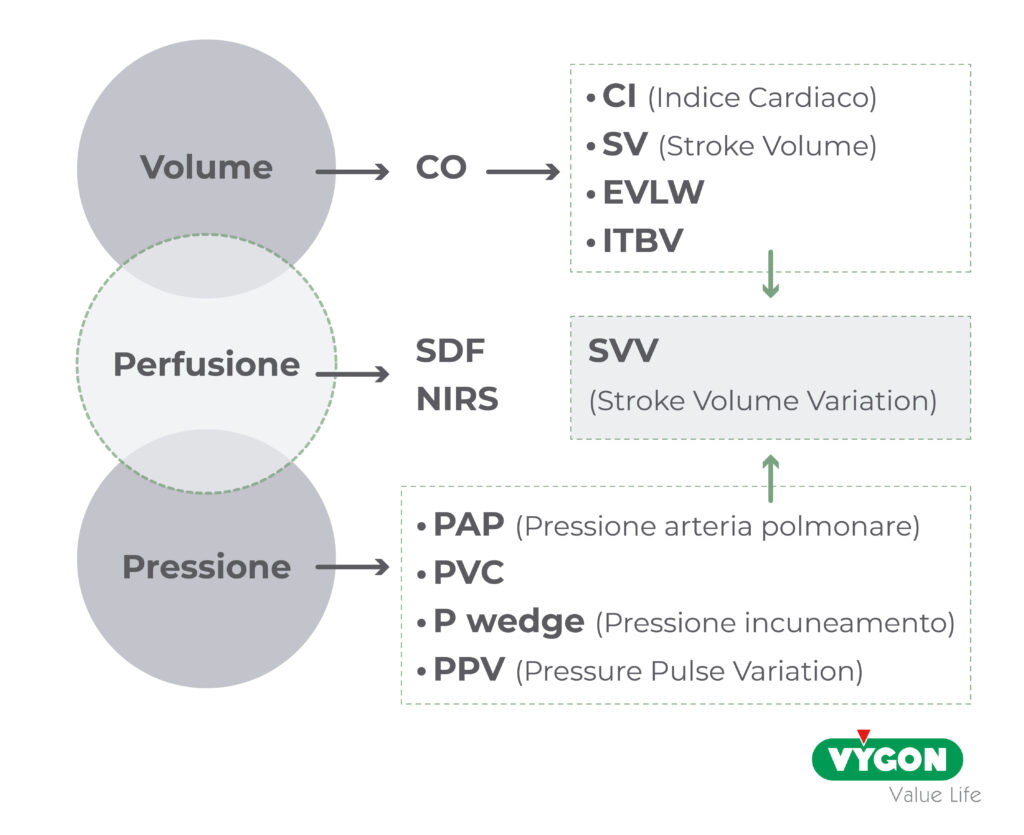
PARAMETRI RILEVANTI NELLA GESTIONE DELLA VOLEMIA
L’introduzione dell’elastanza dinamica Edyn, misurata come il rapporto fra pulse pressure variation PPV e stroke volume variation SVV, permette inoltre di identificare quei pazienti in cui il target dell’espansione volemica è l’incremento della pressione media arteriosa piuttosto che lo stroke volume. Infatti, nelle condizioni di elastanza dinamica più alta, l’infusione di fluidi determinerà una più accentuata riduzione della pulse pressure variation e, di conseguenza, un più accentuato incremento della pressione arteriosa oltre che della portata cardiaca. Al contrario, l’effetto sulla pressione arteriosa media dopo fluido-terapia sarà minimo nelle condizioni di elastanza dinamica bassa (effetto accentuato sullo stroke volume variation).
L’utilizzo degli indici di fluid responsiveness, inoltre, può essere particolarmente utile nella riduzione della volemia per garantire weaning da ventilazione meccanica efficaci. Nel passaggio da ventilazione meccanica a spontanea si assiste ad un aumento del ritorno venoso indotto dalla diminuzione della pressione intratoracica. Negli stati di ipervolemia tale incremento di filling può essere causa di incremento di lavoro cardiorespiratorio non sostenibile e conseguente weaning failure. Il mantenimento di pulse pressure variation PPV o stroke volume variation SVV elevate può aiutare il clinico a mitigare gli effetti emodinamici di overload indotti dall’estubazione. Inoltre, tali indici permettono di mantenere in modo adeguato bilanci fluidici negativi nelle fasi di malattia critica cronica (riduzione del drowning dei pazienti in terapia intensiva).
Tuttavia, gli indici dinamici di fluid responsiveness presentano dei difetti che possono fuorviare il clinico nella comprensione dello stato emodinamico e nell’approccio terapeutico. In particolare, la riduzione dell’escursione della pressione intratoracica, indotta dall’utilizzo di volumi tidalici protettivi, l’ipertensione addominale, le condizioni di fisiologico incremento di polso paradosso (insufficienza destra, alterazione diastolica, ventilazione spontanea) alterano le potenzialità e i valori di riferimento degli indici di fluid responsiveness. Tale situazione è resa ancora più complessa dalla recente individuazione dell’importanza dell’emodinamica venosa. L’infusione di fluidi, infatti, esercita il suo effetto di aumento del precarico attraverso il peculiare incremento della mean systemic filling pressure.
Già descritta da Guyton, la mean systemic filling pressure è la pressione intravascolare (misurata nello stato di fibrillazione ventricolare e quindi in assenza di pompa sistolica), che determina il ritorno di sangue verso il cuore destro. Il flusso venoso di filling cardiaco è di conseguenza il risultato della pressione differenziale fra mean systemic filling pressure e la pressione venosa centrale (waterfall effect) e le resistenze venose.
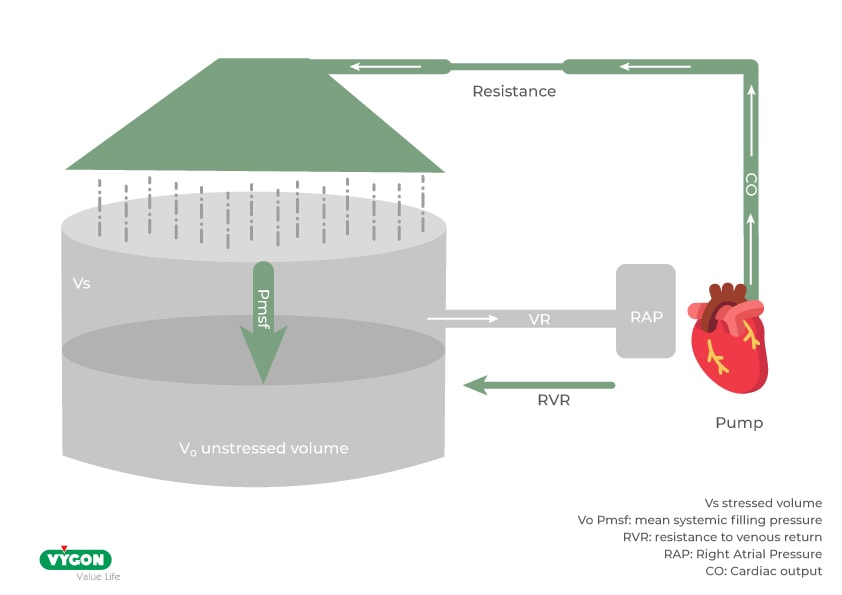
L’incremento della mean systemic filling pressure può essere ottenuto sia attraverso l’infusione fluidica che attraverso il reclutamento di volume dal sistema venoso di capacitanza (passaggio di volume venoso da unstressed a stressed). Tale meccanismo spiega il potenziale effetto fluid sparing and fluid equivalent di basse dosi di noradrenalina sull’incremento del ritorno venoso e successivo incremento della portata senza somministrazione di fluidi.
La riduzione della stasi venosa è un argomento affascinante e innovativo della gestione emodinamica. Infatti, l’incremento della pressione venosa determina la necessità di incremento della pressione media arteriosa per mantenere un flusso costante quando le potenzialità di vasodilatazione capillare sono esaurite.
In questo senso, esistono variegate situazioni in cui la riduzione della pressione venosa centrale permette una perfusione d’organo adeguata anche in presenza di pressioni arteriose medio basse (e sistemi di autoregolazione delle resistenze intraparenchimali intatte) o condizioni drammatiche di stasi venosa ed elevate pressioni venose centrali in cui i target emodinamici di pressioni arteriosa media, sebbene elevati, non sono sufficienti a garantire ossigenazione e in cui la somministrazione ulteriore di liquidi determina solo aggravamento di fluid overloading.
In assenza di misurazioni invasive della pressione venosa centrale, le variazioni di distensibilità e collassabilità delle vene cave misurate ecograficamente permettono di integrare parametri di funzione destra ed efficienza del filling del ventricolo destro ai parametri arteriosi sinistri dinamici.
In questa ottica, il mantenimento dell’accoppiamento fra funzione cardiaca e sistema vascolare rappresenta l’optimum della gestione emodinamica moderna.
L’IMPORTANZA DELL’ACCOPPIAMENTO VENTRICOLO ARTERIOSO
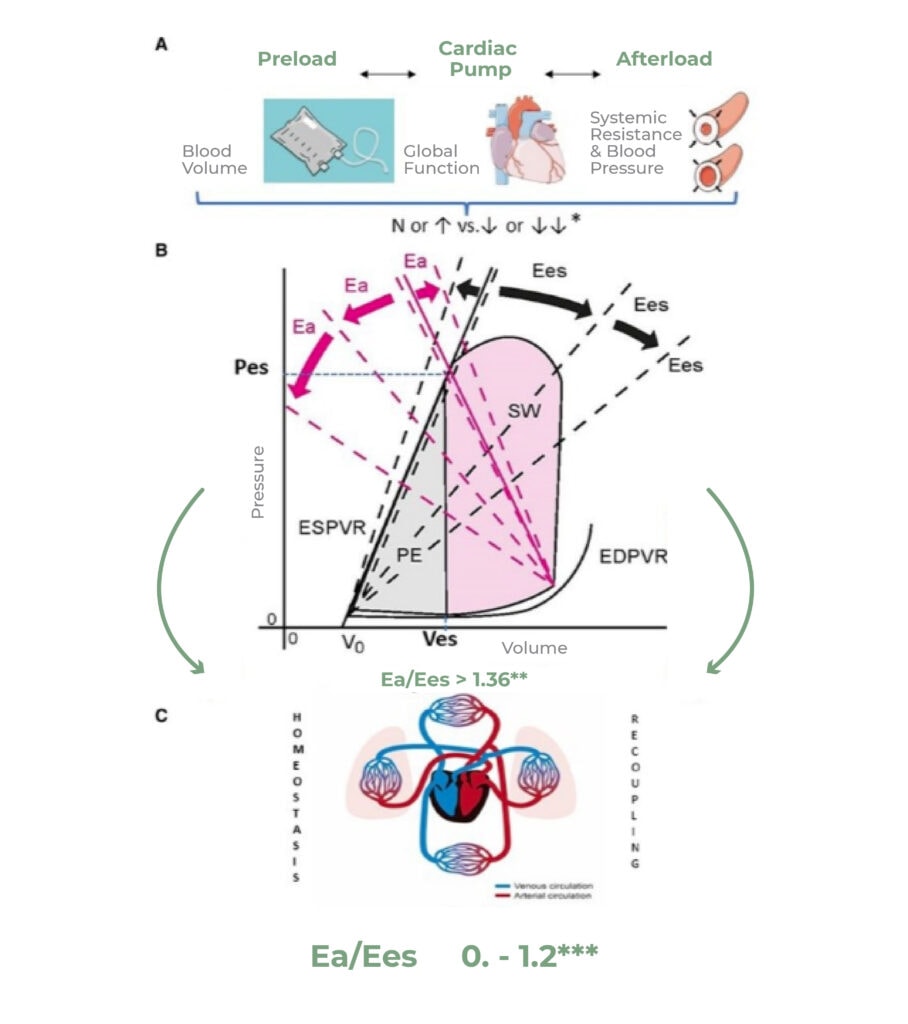
Un sistema emodinamico accoppiato può essere definito come uno stato in cui la funzione cardiaca in un dato stato di filling (elastanza ventricolare = capacità di generare pressione per un dato volume) equivale o risulta superiore all’afterload vascolare (elastanza vascolare effettiva). Le determinanti dell’afterload vascolare, inteso come la forza che il cuore deve vincere per creare un flusso di perfusione periferico, sono costituite dalla somma di resistenze vascolari, impedenza e compliance aortica e componenti di riflessioni arteriosa.
Durante malattia critica il peggioramento dell’accoppiamento ventricolo arterioso determina un dispendio energetico eccessivo da parte del cuore. Gli effetti deleteri di tale uncoupling non sono solo cardiaci, ma l’aumento conseguente delle pressioni di riempimento determina un necessario ribilanciamento del sistema vascolare per garantire perfusione periferica. In questa ottica, il mantenimento dell’accoppiamento ventricolo arterioso non ha quindi lo scopo di mantenere un’efficienza di consumo energetico cardiaco ma può mantenere condizioni più fisiologiche e riduzione di trattamento terapeutico inotropico.
La misurazione dell’accoppiamento ventricolo arterioso è ad oggi di difficile esecuzione e necessita di misurazioni ecocardiografiche precise e talora di non facile esecuzione in tutti i pazienti di terapia intensiva.
Tuttavia, è recentemente emerso come l’elastanza dinamica EDyn sia uno strumento che può suggerire lo stato volemico ma anche un indice che riflette l’accoppiamento ventricolo arterioso. Maggiore è l’elastanza dinamica, minore sarà il rapporto fra elastanza arteriosa effettiva ed elastanza ventricolare (migliore accoppiamento ventricolo arterioso).
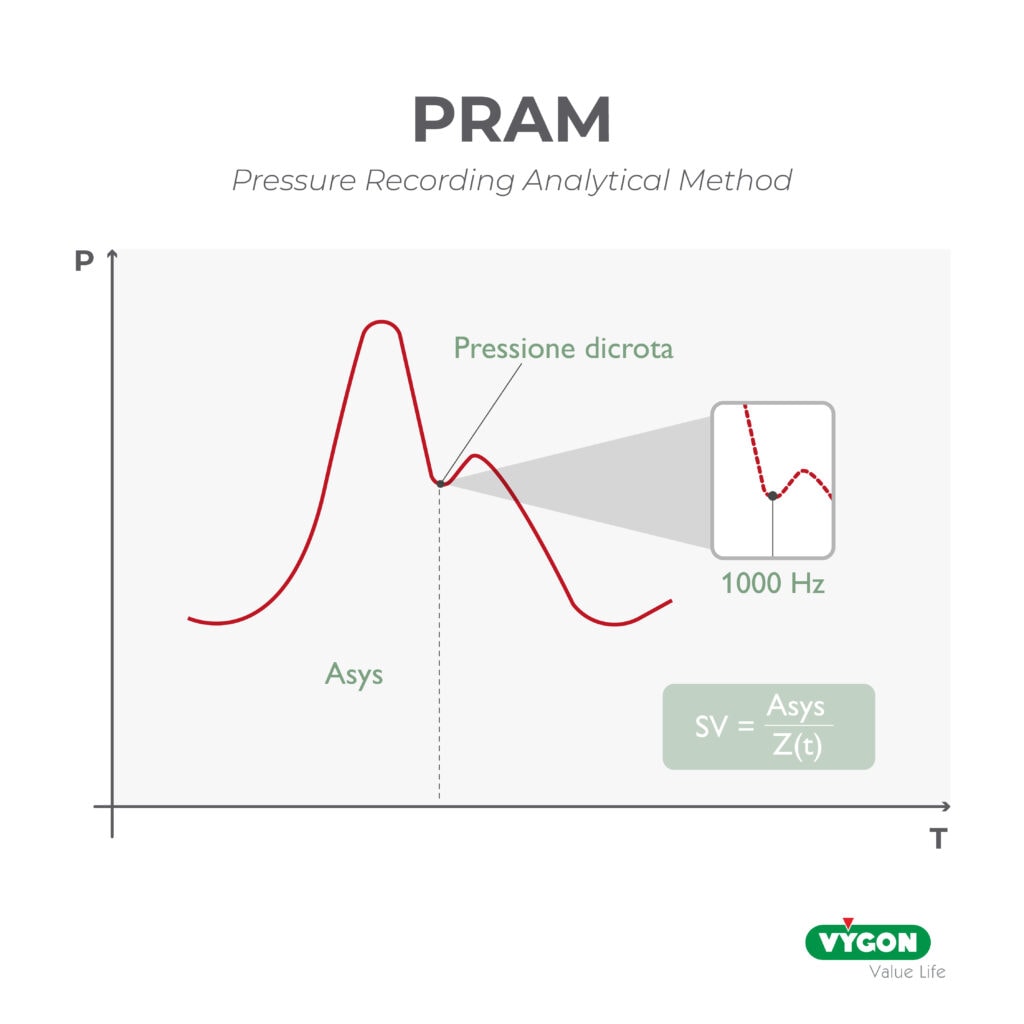
Un altro parametro rilevante per comprendere l’accoppiamento ventricolo arterioso è il Cardiac Cycle Efficiency Index CCE, calcolato dall’algoritmo PRAM attraverso l’analisi complessa della forma d’onda arteriosa, che estrapola indirettamente dati di funzione cardiaca, impedenza vascolare e stato volemico. Tale parametro si è rivelato particolarmente utile nella valutazione dello stato di accoppiamento ventricolo arterioso perché permette di associare i comuni indici di fluid responsiveness ed emodinamici a condizioni di efficienza energetica del sistema.
In conclusione, la complessità della gestione emodinamica del paziente critico non può essere standardizzata ma è il frutto di un adattamento continuo della terapia ad uno stato complesso in cui l’interazione fra sistema vascolare artero-venoso, cardiaco e condizione clinica devono essere valutati e modificati per l’ottenimento di target individualizzati.
Quindi in un contesto di necessità di gestione multiparametrica di indirizzo clinico emodinamico, un aiuto futuro sarà la possibilità di avvalersi di analisi di intelligenza artificiale. La scelta clinica coadiuvata da calcoli e rivalutazioni temporali di dati, permetterà di impostare terapie mirate e scevre da errori di valutazione, sempre più inserite in un contesto clinico anamnestico evolutivo e peculiare.
PRODOTTI CORRELATI
BIBLIOGRAFIA
1) Monnet, X., Shi, R. & Teboul, JL. Prediction of fluid responsiveness. What’s new?. Ann. Intensive Care 12, 46 (2022). https://doi.org/10.1186/s13613-022-01022-8
2) Jozwiak M, Monnet X, Teboul JL. Prediction of fluid responsiveness in ventilated patients. Ann Transl Med. 2018 Sep;6(18):352. doi: 10.21037/atm.2018.05.
3) Monge García MI, Jian Z, Hatib F, Settels JJ, Cecconi M, Pinsky MR. Dynamic Arterial Elastance as a Ventriculo-Arterial Coupling Index: An Experimental Animal Study. Front Physiol. 2020 Apr 6;11:284. doi: 10.3389/fphys.2020.00284
4) Persichini, R., Lai, C., Teboul, JL. et al. Venous return and mean systemic filling pressure: physiology and clinical applications. Crit Care 26, 150 (2022). https://doi.org/10.1186/s13054-022-04024-x
5) Demailly Z, Besnier E, Tamion F, Lesur O. Ventriculo-arterial (un)coupling in septic shock: Impact of current and upcoming hemodynamic drugs. Front Cardiovasc Med. 2023 May 30;10:1172703. doi: 10.3389/fcvm.2023.1172703. PMID: 37324631
6) Demailly Z, Besnier E, Tamion F, Lesur O. Ventriculo-arterial (un)coupling in septic shock: Impact of current and upcoming hemodynamic drugs. Front Cardiovasc Med. 2023 May 30;10:1172703. doi: 10.3389/fcvm.2023.1172703. PMID: 37324631