L’Elastanza Arteriosa è una caratteristica fisica dei vasi arteriosi che recentemente è stata indagata in molti studi scientifici al fine di identificarne una possibile interpretazione e correlazione nell’ambito del monitoraggio emodinamico avanzato nei pazienti critici per migliorare sempre di più la gestione fluidica e la somministrazione di terapie mirate.
Questi studi sono stati resi possibili dal fatto che nei nuovi sistemi di monitoraggio emodinamico è possibile identificare in modo mininvasivo ed accurato il valore dell’Elastanza Arteriosa.
Nel seguente articolo richiameremo alcuni principi di fisiologia dell’apparato cardiovascolare, in modo da poter introdurre con maggior chiarezza quelle che sono le recenti scoperte su questo innovativo parametro emodinamico.
Cos’è l’Elastanza Arteriosa?
Il Sistema Cardiovascolare è composto dal cuore e dai vasi e la sua funzione è quella di garantire che il sangue, ricco di ossigeno e nutrienti, raggiunga tutte le cellule e i tessuti. Un aspetto cruciale di questo sistema è rappresentato dall’elastanza arteriosa, che svolge un ruolo fondamentale nella regolazione della pressione sanguigna e nella salute generale dell’apparato cardiovascolare.
L’elastanza arteriosa si riferisce alla capacità di un vaso arterioso di espandersi e ritornare alla sua forma originale dopo essere stato sottoposto a una deformazione.
Quando il cuore pompa il sangue nelle arterie durante la sistole, queste subiscono una distensione. L’elastanza permette alle pareti arteriose di adattarsi a questa pressione, espandendosi durante la sistole e ritornando alla forma originale durante la diastole. Questa caratteristica è essenziale per mantenere una pressione arteriosa e un flusso sanguigno costanti e per evitare danni ai vasi sanguigni.
Da cosa dipende l’Elastanza Arteriosa?
Le componenti principali della parete arteriosa che determinano l’elastanza arteriosa e il suo comportamento non lineare sono l’elastina, il collagene e le cellule muscolari lisce (SMC). La distribuzione di queste componenti differisce nettamente tra le arterie centrali elastiche e quelle periferiche muscolari: nelle arterie elastiche la componente dominante è rappresentata dall’elastina, mentre le arterie muscolari sono formate principalmente da collagene e da tessuto muscolare liscio.
Grazie alle proprietà elastiche delle grandi arterie, parte dell’energia della contrazione ventricolare viene immagazzinata nella parete arteriosa sotto forma di energia potenziale durante la sistole e poi viene rilasciata come energia cinetica durante la diastole. Quanto più rigida è la parete delle arterie, minore è l’energia potenziale immagazzinata al loro interno durante la contrazione ventricolare e l’espulsione del sangue.
Pertanto, la pressione in sistole aumenta a causa dell’incapacità di conversione dell’energia cinetica in energia potenziale durante l’eiezione, e la pressione diastolica diminuisce a causa della mancata disponibilità di energia potenziale disponibile per la riconversione in energia cinetica durante la diastole.
Come si calcola l’Elastanza Arteriosa?
Per descrivere la capacità del carico elastico di modificare il proprio volume al variare della pressione interna, viene comunemente utilizzata la Compliance, grandezza definita come il rapporto tra la variazione di volume e la variazione della pressione che l’ha generata. Secondo tale determinazione, la compliance è la grandezza inversa all’elastanza ed è una misura della distensibilità elastica del vaso.
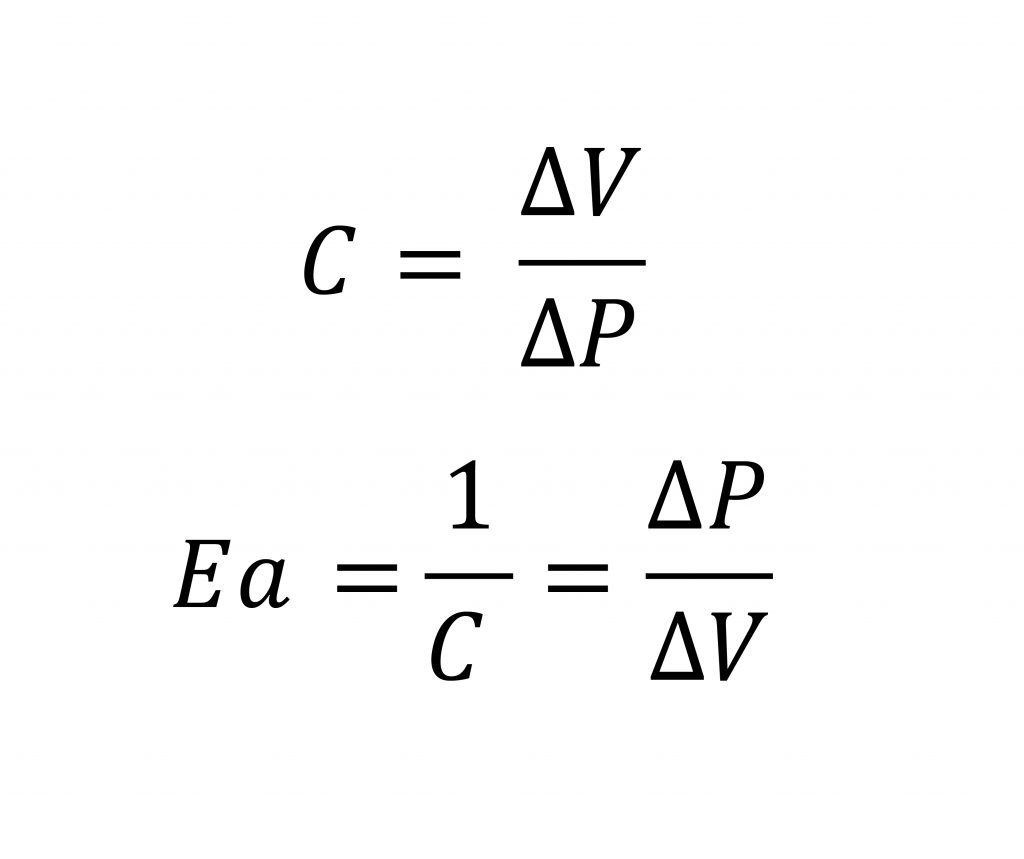
L’elastanza arteriosa può quindi essere determinata fisiologicamente dal rapporto tra pressione a fine sistole e lo stroke volume. La pressione di fine sistole corrisponde alla pressione alla quale avviene la chiusura della valvola aortica, chiamata anche pressione dicrotica.
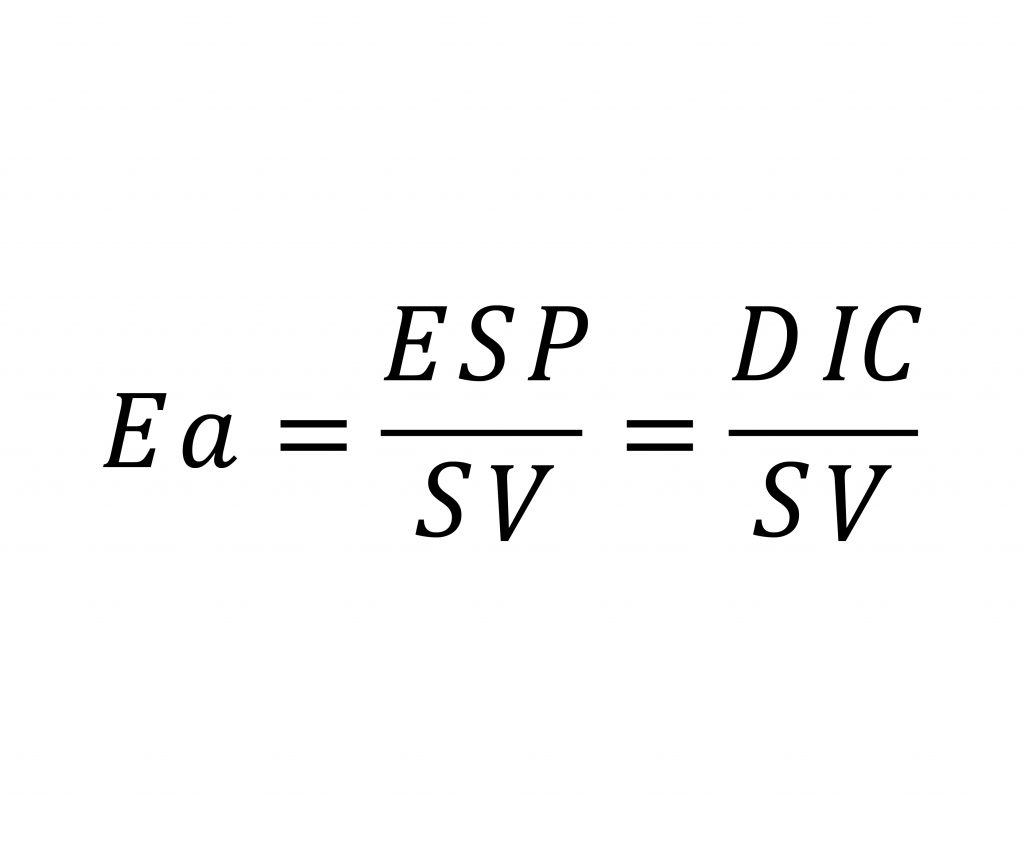
L’elastanza arteriosa è quindi una delle componenti del cosiddetto postcarico che il ventricolo sinistro si trova ad affrontare durante la fase di sistole e quindi di eiezione dello stroke volume.
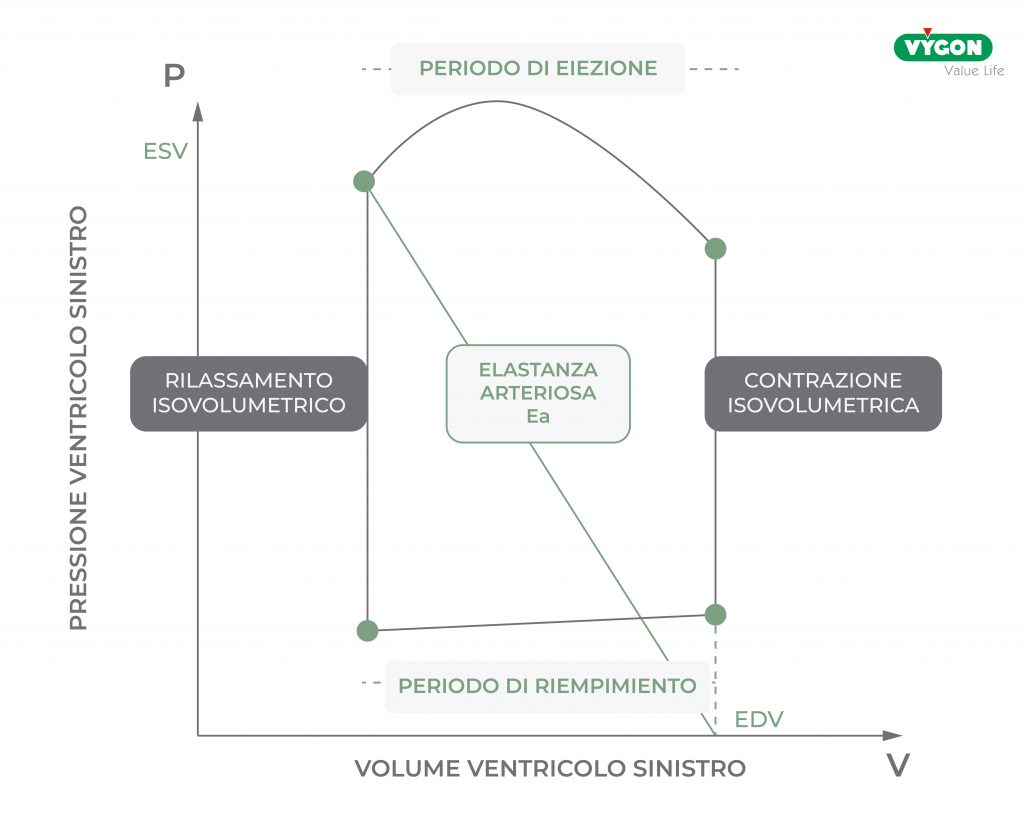
Come si posiziona il grafico dell’elastanza arteriosa all’interno del diagramma pressione-volume del ventricolo sinistro?
Rivediamo brevemente il diagramma pressione-volume.
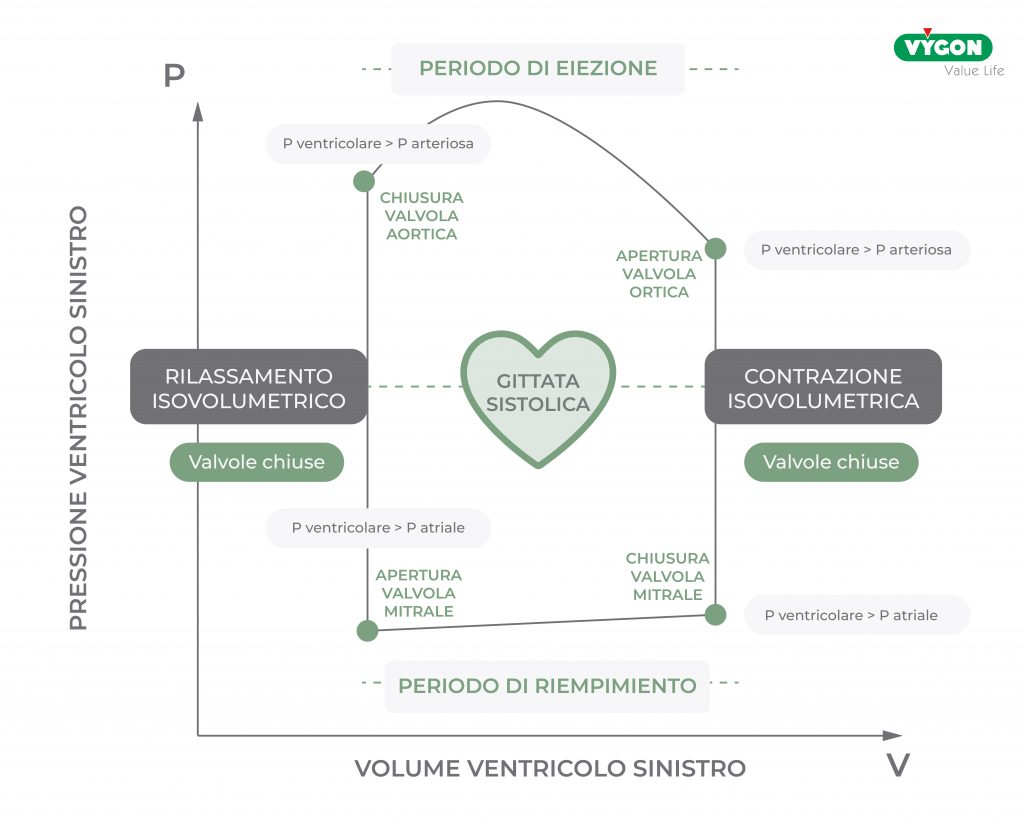
Partendo dal punto di chiusura della valvola mitrale e quindi dal punto di fine diastole, qui inizia la contrazione, la pressione inizia ad aumentare, ma fino a che è inferiore alla pressione aortica la valvola aortica è chiusa. Entrambe le valvole sono chiuse, il volume è costante, e per questo motivo questa fase è chiamata di contrazione isovolumetrica.
Quando la pressione diventa superiore alla pressione aortica e la valvola aortica si apre, si avvia la fase di espulsione del sangue dal ventricolo sinistro, detto periodo di eiezione. Al termine di questa fase, la pressione si riabbassa e scende sotto la pressione aortica e la valvola si chiude. Avviene quindi un rilassamento isovolumetrico, la pressione continua a scendere ma le valvole sono chiuse e il volume è costante. Quando la pressione scende al di sotto della pressione atriale e la valvola mitrale si apre, si avvia il riempimento diastolico: il sangue fluisce dall’atrio sinistro al ventricolo sinistro. La contrazione atriale completa il riempimento ventricolare.
Riprendendo la formula dell’elastanza
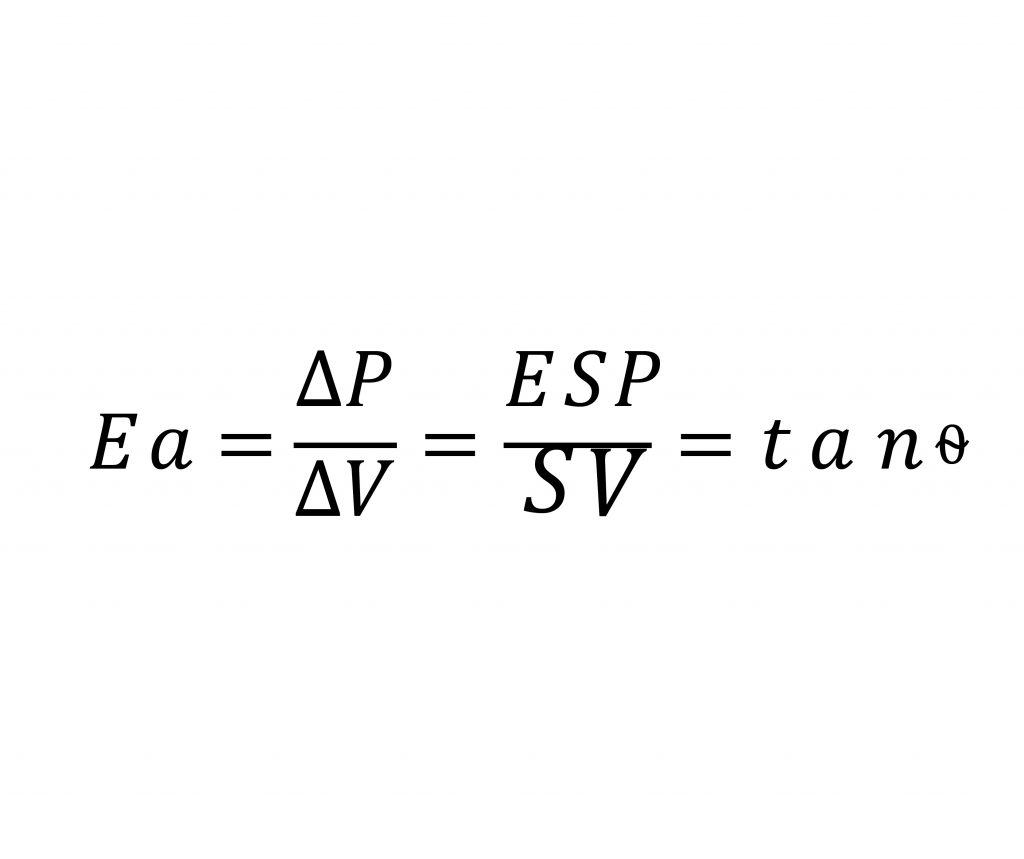
La sua visualizzazione grafica sul diagramma Pressione-Voume del ventricolo sinistro risulta essere la seguente:
E’ possibile utilizzare l’Elastanza Arteriosa come parametro per migliorare la gestione emodinamica del paziente?
Sono diversi gli studi recenti che includono il parametro di Elastanza Arteriosa nelle considerazioni relative allo stato emodinamico del paziente e soprattutto alla sua risposta a determinate decisioni terapeutiche. Questi studi sono stati resi possibili dal fatto che nei nuovi sistemi di monitoraggio emodinamico è possibile identificare il valore della pressione di fine sistole, definito pressione dicrotica, dall’analisi della curva di pressione arteriosa, e soprattutto è possibile conoscere in modo affidabile il valore dello stroke volume ad ogni battito tramite il calcolo dell’impedenza cardiovascolare del paziente. Per ogni battito, quindi, viene reso disponibile il valore dell’Elastanza Arteriosa.
Nello studio Bond et. Al 2019 ad esempio è stata dimostrata una riduzione significativa dell’Elastanza Arteriosa dopo che al paziente veniva somministrato un carico di fluidi. La somministrazione di fluidi è uno degli interventi terapeutici più frequentemente utilizzati per aumentare la pressione arteriosa e la gittata cardiaca in presenza di sospetta ipovolemia. Nei pazienti in shock settico, in presenza di una grande vasodilatazione, la pressione arteriosa però potrebbe non aumentare anche se la Gittata Cardiaca aumenta e i pazienti sono quindi fluid responder. La diminuzione dell’Elastanza Arteriosa dopo la somministrazione di fluidi è coerente anche con altri studi e supporta il valore dell’elastanza arteriosa come indice di fluid responsiveness nei pazienti critici.
Nello studio di Morelli et al. 2016 sono stati studiati gli effetti della riduzione della frequenza cardiaca sull’elastanza arteriosa in pazienti con shock settico. Attraverso il farmaco beta-bloccante Esmololo, la frequenza cardiaca inizialmente sopra i 95 bpm è stata ridotta e in tutti i pazienti si sono verificati una riduzione dell’elastanza arteriosa ed un parallelo aumento dello stroke volume. Sebbene la gittata cardiaca e la frazione di eiezione siano rimaste invariate, il fabbisogno di norepinefrina è stato ridotto. L’Elastanza arteriosa è infatti un importante determinante dell’accoppiamento ventricolo arterioso, la sua riduzione può contribuire a migliorare l’efficienza cardiovascolare e garantire un’adeguata perfusione sistemica nei pazienti con shock settico grave.
Il disaccoppiamento ventricolo arterioso è associato a un’inefficienza cardiovascolare e ad un’energia miocardica sfavorevole che può peggiorare progressivamente nel corso di una patologia. La tachicardia aumenta anche il consumo di ossigeno da parte del miocardio e, accorciando il tempo di rilassamento diastolico, può compromettere la perfusione coronarica. Tutti questi effetti possono contribuire ulteriormente alla disfunzione miocardica e a un esito sempre più sfavorevole. Poiché l’Ea è determinata linearmente dal volume stroke volume, qualsiasi miglioramento del tempo diastolico e del riempimento diastolico (tramite diminuzione della frequenza cardiaca) può influenzare direttamente l’Elastanza Arteriosa.
Nello studio di Messina et al. 2017 troviamo nuovamente una correlazione tra l’Elastanza Arteriosa e la risposta alla somministrazione di fluidi in pazienti in shock settico. Anche in questo studio è stato dimostrato infatti come l’Elastanza Arteriosa abbia riportato riduzioni significative nei pazienti che di fatto erano fluid responder, a differenza di quelli che non lo erano, e come in questi pazienti non sia possibile fare affidamento invece sui valori di PPV, normalmente utilizzato come indice di fluid responsiveness.
L’Elastanza arteriosa emerge quindi come un indicatore prezioso per migliorare la gestione emodinamica dei pazienti critici. Tale parametro apre infatti nuove prospettive nella valutazione della dinamica cardiovascolare, suggerendo approcci terapeutici più personalizzati. Integrare consapevolmente questo parametro nella pratica clinica può contribuire a ottimizzare l’efficienza cardiovascolare, garantendo una gestione più mirata ed efficace dei pazienti.
Bibliografia
Nichols WW, Edwards DG. Arterial elastance and wave reflection augmentation of systolic blood pressure: deleterious effects and implications for therapy. J Cardiovasc Pharmacol Ther. 2001 Jan;6(1):5-21. doi: 10.1177/107424840100600102. PMID: 11452332.
Chirinos JA. Arterial stiffness: basic concepts and measurement techniques. J Cardiovasc Transl Res. 2012 Jun;5(3):243-55. doi: 10.1007/s12265-012-9359-6. Epub 2012 Mar 24. PMID: 22447229.
Bond O, De Santis P, Iesu E, Franchi F, Vincent JL, Creteur J, Taccone FS, Scolletta S. Relationship between Microcirculatory Perfusion and Arterial Elastance: A Pilot Study. Crit Care Res Pract 2019 Mar 26;2019:3256313.
Morelli A, Singer M, Ranieri VM, D’Egidio A, Mascia L, Orecchioni A, Piscioneri F, Guarracino F, Greco E, Peruzzi M, Biondi-Zoccai G, Frati G, Romano SM. Heart rate reduction with esmolol is associated with improved arterial elastance in patients with septic shock: a prospective observational study. Intensive Care Med 2016.
Messina A, Romano SM, Bonicolini E, Colombo D, Cammarota G, Chiostri M, Della Corte F, Navalesi P, Payen D, Romagnoli S. Cardiac cycle efficiency and dicrotic pressure variations: new parameters for fluid therapy: A pilot observational study. Eur J Anaesthesiol 2017; 34:1–9.
Guarracino F, Bertini P, Pinsky MR. Cardiovascular determinants of resuscitation from sepsis and septic shock. Crit Care 2019 Apr 15;23(1):118.