Un aspetto fondamentale nella gestione del paziente critico è mantenere la stabilità emodinamica e ottimizzare perfusione d’organo, al fine di mantenerne il corretto funzionamento. L’evidenza clinica ha dimostrato che la GDT (Goal Directed Therapy), che mira a monitorare la SV per guidare la somministrazione di fluidi e farmaci, ha un impatto benefico nel trattamento dei pazienti sia in terapia intensiva che in sala operatoria.
Anche solo il sovraccarico di liquidi è frequentemente riscontrato nei pazienti in condizioni critiche con lesioni renali acute ed è correlato a un aumento della mortalità o porta a diverse complicazioni. Nei pazienti sottoposti a chirurgia maggiore uno dei componenti chiave del percorso di recupero avanzato è la gestione ottimale dei fluidi e dell’emodinamica, che può ridurre le complicanze postoperatorie fino al 50%.
L’IMPORTANZA DEL PROTOCOLLO GOAL DIRECTED THERAPY (GDT)
Sono circa 310 milioni i pazienti che si sottopongono ogni anno ad un intervento chirurgico in tutto il mondo. Le complicanze postoperatorie aumentano i costi diretti per il trattamento e riducono sia l’aspettativa che la qualità della vita del paziente. Non si dispone di una consapevolezza globale di tutti gli esiti post-operatori, ma le stime dei Paesi ad alto reddito suggeriscono come in un 20% dei pazienti si verifichino complicanze post-operatorie, con una mortalità che varia dall’1 al 4%. [1]
The International Surgical Outcomes Study Group ha condotto uno studio prospettico internazionale sugli esiti a 7 giorni dopo intervento chirurgico in 27 Paesi, il 16,8% ha sviluppato una o più complicanze postoperatorie e lo 0,5% sono morti. [2]
Il tasso di decessi postoperatori è una misura del successo dei sistemi di assistenza chirurgica e il miglioramento di questa e il miglioramento di questo parametro sono una priorità globale. Il database inglese HES-ONS è uno dei database più completi al mondo, grazie ad esso è stato possibile stimare quanti pazienti muoiono entro 30 giorni da un intervento chirurgico.
Questa analisi suggerisce che almeno 4,2 milioni di persone nel mondo muoiono entro 30 giorni dall’intervento chirurgico ogni anno e la metà di questi decessi avviene nei paesi a basso e medio reddito.
Questo numero di decessi post-operatori rappresenta il 7,7% di tutti i decessi a livello globale e rappresenta la terza causa di morte dopo ischemia cardiaca e ictus. Ogni anno muoiono più persone entro 30 giorni dall’intervento chirurgico che di tutte le cause legate all’HIV, alla malaria e alla tubercolosi messe insieme (2,97 milioni di persone).
Negli ultimi decenni, la GOLD DIRECTED THERAPY ha acquisito un grande interesse nell’ambito peri-operatorio. A differenza dell’assistenza guidata dai tradizionali segni vitali, il principio GDT è che la somministrazione di fluidi e vasopressori sia guidata da obiettivi espliciti che mirano a quantificare la perfusione d’organo, quindi Indice Cardiaco (CI), la Variazione dello Stroke Volume (SVV) o l’apporto di ossigeno (DO2). Se storicamente tali indici sono stati misurati da cateteri dell’arteria polmonare (PAC), recentemente si sono diffuse tecnologie meno invasive, quali l’analisi della forma d’onda arteriosa.
Data l’importanza clinica della GDT e il suo potenziale per migliorare gli esiti dei pazienti, vale la pena approfondire quali di questi interventi siano realmente efficaci o meno.
Una recente revisione sistematica e meta-analisi ha considerato come esito primario la mortalità e come esiti secondari la morbilità organo-specifica. Sulla base degli articoli inclusi in questa analisi, i numeri suggeriscono che per ogni 1000 pazienti trattati con GDT, si eviterebbero 18 decessi.
I benefici secondari della moderna GDT comprendono 30 casi in meno di aritmia, 27 casi in meno di polmonite e 55 casi in meno di infezione della ferita ogni 1.000 pazienti trattati con GDT.[3]
ALGORITMI INNOVATIVI NEI PULSE CONTOUR METHOD
Le Linee Guida SIAARTI sulla “Gestione emodinamica perioperatoria del paziente adulto in chirurgia non cardiaca” suggeriscono l’utilizzo di dispositivi per il monitoraggio emodinamico in grado di stimare e monitorare lo Stroke Volume e la Gittata Cardiaca associati al calcolo del Delivery di Ossigeno DO2, insieme a parametri dinamici quali la Variazione della Pressione di Picco (PPV) e la Variazione dello Stroke Volume (SVV), in pazienti ad alto rischio sottoposti a chirurgia non cardiaca. Parametri statici quali le pressioni arteriose non sono infatti indicativi del debito d’ossigeno in cui può incorrere il paziente, perché alterati da meccanismi di compensazione dell’organismo.
In passato queste informazioni erano di difficile accesso perché richiedevano misurazioni molto invasive, a cui era associata una certa probabilità di complicanze per il paziente. Ad oggi esistono invece dei sistemi di monitoraggio emodinamico molto meno invasivi e che si basano sull’analisi della forma d’onda di pressione arteriosa per calcolare lo Stroke Volume del paziente e, a cascata, tutti gli altri parametri emodinamici. Questi sistemi si chiamano Pulse Contour Method PCM e legano le variazioni di pressione arteriosa alle variazioni della gittata sistolica.
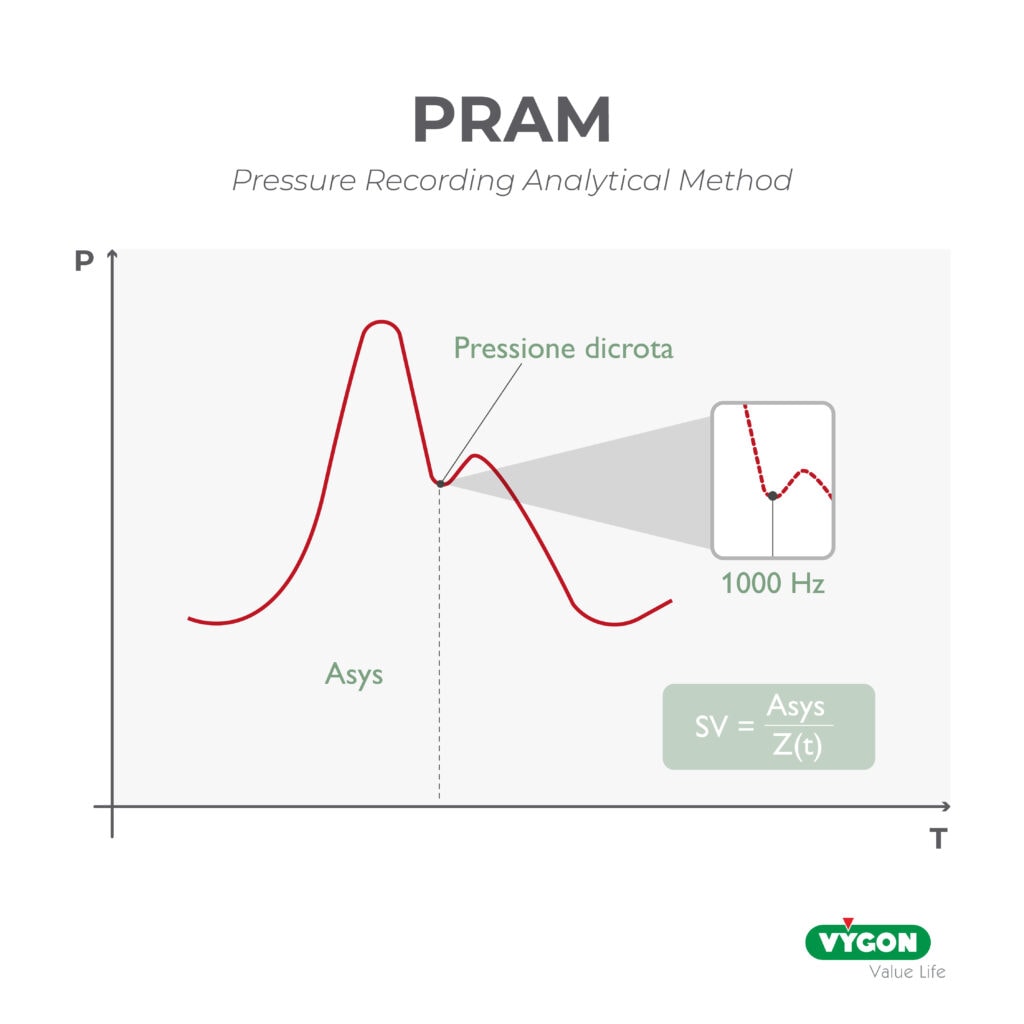
Storicamente questi sistemi sono sempre stati considerati meno affidabili delle metodiche più invasive, ma la tecnologia su cui alcuni di loro si basano, come ad esempio i sistemi che implementano il brevettato algoritmo PRAM, ha permesso di ottenere risultati paragonabili a quelli dello Swan Ganz, della termodiluizione e dell’ecocardiografia.
Alcuni studi hanno infatti dimostrato come le differenze tra i valori ottenuti da tale algoritmo in confronto a questi sistemi siano ampiamente sotto al 30%, in alcuni casi anche intorno al 15%, rendendoli perfettamente interscambiabili e permettendone quindi una vera e propria validazione. [4,5,6,8]
Per rendere ancora più affidabili questi sistemi, che dipendono esclusivamente dalla lettura dell’onda arteriosa, sono stati sviluppati dei filtri elettronici per l’attenuazione della risonanza, che identificano la presenza di interferenze sulla forma dell’onda (di cui sono affetti circa un 30% di segnali arteriosi) e intervengono in autonomia per pulire il segnale e renderlo più affidabile e realistico. Questi filtri sono stati recentemente studiati ed analizzati ed è stato provato come siano perfettamente interscambiabili con i filtri meccanici utilizzati fino ad ora. [7]
Oltre a SV, gittata cardiaca, resistenze e indici di riempimento, esistono altri parametri che possono dare informazioni rilevanti su ulteriori aspetti clinici del paziente. Data l’affidabilità di questi parametri ottenuti con le tecnologie più recenti, è stato possibile indagare approfonditamente questi aspetti e ottenere importanti consapevolezze su come utilizzarli nella pratica clinica.
A supporto di quanto finora descritto, sono stati portati avanti numerosi studi che dimostrano quanto questi nuovi parametri migliorino la gestione del paziente critico. In particolare, ci soffermiamo su quelli inerenti a:
- Efficienza del Ciclo Cardiaco e Frazione di Eiezione del Ventricolo Sinistro
- Elastanza arteriosa ed utilizzo dell’Esmololo
- Elastanza Dinamica e riduzione di Norepinefrina
1. Efficienza del Ciclo Cardiaco e Frazione di Eiezione del Ventricolo Sinistro
Un indice che sta raccogliendo molto interesse è quello relativo all’Efficienza del Ciclo Cardiaco CCE, parametro esclusivo dell’algoritmo PRAM.
Questo indice attraverso l’analisi puntuale del lavoro svolto dal cuore e l’impedenza offerta dall’albero circolatorio del paziente, restituisce un’indicazione sull’equilibrio dell’intero ciclo cardiaco, più nello specifico dell’energia necessaria al cuore per generare un determinato SV in seguito all’interazione con il sistema arterioso, trovando quindi forte correlazione con aspetti quali l’accoppiamento ventricolo-arterioso e la frazione di eiezione del ventricolo sinistro.
In uno studio del 2013 di Scolletta et al., è stato indagato il rapporto tra il CCE calcolato dal PRAM e la frazione di eiezione del ventricolo sinistro valutata tramite ECG in pazienti critici di terapia intensiva.
Il risultato ottenuto è che il CCE può fungere da indice di predittività di scarsa frazione di eiezione del ventricolo sinistro (LVEF), in quanto valori di CCE inferiori a 0.07 predicono una LVEF inferiore al 40%, con una sensibilità del 93% e una specificità del 96%. Al contrario, valori di CCE superiori a 0.12 predicono una LVEF superiore al 50% con una sensibilità del 96% e una specificità del 82%. [9]
2. Elastanza arteriosa ed utilizzo dell’Esmololo
Il valore dell’elastanza arteriosa, indicativa del tono arterioso e componente del post carico del paziente, non è sempre accessibile e di facile calcolo in quanto pari al rapporto tra la pressione di fine sistole e lo SV. La pressione di fine sistole in molti sistemi viene approssimata, a meno che il sistema non sia in grado di identificare l’incisura dicrota (punto della curva arteriosa relativo alla chiusura della valvola aortica e quindi della fine della fase di sistole) e di conseguenza di misurarne la pressione.
Attraverso l’algoritmo PRAM tale calcolo è possibile e l’indicazione esatta di questo parametro permette di avanzare molte considerazioni relative alla clinica del paziente e associare l’effetto di specifici farmaci sull’elastanza arteriosa e la loro capacità di migliorare la performance cardiovascolare globale. In uno studio del 2016 di Morelli et al., è stato valutato l’effetto del farmaco Esmololo (beta-bloccante per il trattamento della tachicardia) in pazienti in shock settico tachicardici e sotto norepinefrina, per mantenere la MAP (Pressione Arteriosa Media) superiore a 65 mmHg.
In questi pazienti si è visto che l’utilizzo di Esmololo non solo va a ridurre la tachicardia riducendo il consumo di ossigeno del cuore e permettendo un miglior riempimento del ventricolo sinistro, ma che va anche a diminuire l’elastanza arteriosa migliorando, quindi, il tono dei vasi arteriosi e la loro risposta al lavoro del cuore. [10]
3. Elastanza Dinamica e riduzione di Norepinefrina
A differenza dell’elastanza arteriosa, l’elastanza dinamica è calcolata come il rapporto tra PPV e SVV, ed è stata suggerita come variabile che rappresenta i cambiamenti dinamici del carico e del tono arterioso nei pazienti ventilati meccanicamente. Questo valore risulta attendibile quando PPV ed SVV vengono calcolati attraverso due metodiche separate, e questo avviene solamente nei PCM non calibrati, che implementano l’algoritmo PRAM.
In uno studio del 2022 di Persona et al., è stato dimostrato che questo parametro può essere utilizzato come predittore della risposta, in termini di mantenimento della MAP (pressione arteriosa media) del paziente in shock settico, nel quale, come da linee guida, si effettua una de-escalation di norepinefrina. Quando infatti si è ristabilito l’equilibrio emodinamico, è consigliata una pronta diminuzione dei vasopressori per evitare ipoperfusione dovuta ad eccessiva vasocostrizione.
Se questa riduzione però è troppo precoce, comunque si va incontro a una ricaduta della MAP e a una conseguente ipoperfusione. Sebbene la norepinefrina sia considerato il miglior farmaco vasopressore da utilizzare in pazienti settici, non è ancora chiaro quando diminuire e interromperne la somministrazione.
In questo studio si è cercato di trovare una correlazione tra l’elastanza dinamica del paziente e la probabilità che la sua MAP diminuisca del 10% dopo 30 minuti di riduzione della norepinefrina, e tale correlazione è stata individuata in un valore soglia dell’elastanza dinamica pari a 0.84 (sensitività del 71% e specificità del 89%). [11]
Questi sono solo alcuni degli studi che negli ultimi anni sono stati effettuati in ambito di gestione emodinamica del paziente critico. Come abbiamo visto le più recenti tecnologie in ambito di monitoraggio emodinamico consentono di calcolare i valori emodinamici del paziente con affidabilità e rapidità, oltre che con un grado minimo di invasività, lasciando spazio a uno scenario immenso di applicazioni e di approfondimenti che possono portare a investigare la clinica e, soprattutto, tutte le possibili soluzioni per una gestione sempre più ottimale del paziente critico.
PRODOTTI CORRELATI
BIBLIOGRAFIA
- International Surgical Outcomes Study group. Global patient outcomes after elective surgery: prospective cohort study in 27 low-, middle- and high-income countries. Br J Anaesth. 2016 Oct 31;117(5):601-609. doi: 10.1093/bja/aew316. Erratum in: Br J Anaesth. 2017 Sep 1;119(3):553. PMID: 27799174; PMCID: PMC5091334.
- Nepogodiev D, Martin J, Biccard B, Makupe A, Bhangu A; National Institute for Health Research Global Health Research Unit on Global Surgery. Global burden of postoperative death. Lancet. 2019 Feb 2;393(10170):401. doi: 10.1016/S0140-6736(18)33139-8. PMID: 30722955.
- Chong MA, Wang Y, Berbenetz NM, McConachie I. Does goal-directed haemodynamic and fluid therapy improve peri-operative outcomes?: A systematic review and meta-analysis. Eur J Anaesthesiol. 2018 Jul;35(7):469-483. doi: 10.1097/EJA.0000000000000778. PMID: 29369117.
- Greiwe G, Luehsen K, Hapfelmeier A, Rogge D, Kubik M, Schulte-Uentrop L, Saugel B. Cardiac output estimation by pulse wave analysis using the pressure recording analytical method and intermittent pulmonary artery thermodilution: A method comparison study after off-pump coronary artery bypass surgery. Eur J Anaesthesiol. 2020 Oct;37(10):920-925. doi: 10.1097/EJA.0000000000001227. PMID: 32398582.
- Scolletta S, Franchi F, Romagnoli S, Carlà R, Donati A, Fabbri LP, Forfori F, Alonso-Iñigo JM, Laviola S, Mangani V, Maj G, Martinelli G, Mirabella L, Morelli A, Persona P, Payen D; Pulse wave analysis Cardiac Output validation (PulseCOval) Group. Comparison Between Doppler-Echocardiography and Uncalibrated Pulse Contour Method for Cardiac Output Measurement: A Multicenter Observational Study. Crit Care Med. 2016 Jul;44(7):1370-9. doi: 10.1097/CCM.0000000000001663. PMID: 27097293.
- Persona P, Valeri I, Saraceni E, De Cassai A, Calabrese F, Navalesi P. Cardiac Output Evaluation on Septic Shock Patients: Comparison between Calibrated and Uncalibrated Devices during Vasopressor Therapy. J Clin Med. 2021 Jan 9;10(2):213. doi: 10.3390/jcm10020213. PMID: 33435270; PMCID: PMC7826755.
- Foti L, Michard F, Villa G, Ricci Z, Romagnoli S. The impact of arterial pressure waveform underdamping and resonance filters on cardiac output measurements with pulse wave analysis. Br J Anaesth. 2022 Jul;129(1):e6-e8. doi: 10.1016/j.bja.2022.03.024. Epub 2022 Apr 19. PMID: 35459533.
- Romagnoli S, Ricci Z, Quattrone D, Tofani L, Tujjar O, Villa G, Romano SM, De Gaudio AR. Accuracy of invasive arterial pressure monitoring in cardiovascular patients: an observational study. Crit Care. 2014 Nov 30;18(6):644. doi: 10.1186/s13054-014-0644-4. PMID: 25433536; PMCID: PMC4279904.
- Scolletta S, Bodson L, Donadello K, Taccone FS, Devigili A, Vincent JL, De Backer D. Assessment of left ventricular function by pulse wave analysis in critically ill patients. Intensive Care Med. 2013 Jun;39(6):1025-33. doi: 10.1007/s00134-013-2861-8. Epub 2013 Mar 9. PMID: 23474659.
- Morelli A, Singer M, Ranieri VM, D’Egidio A, Mascia L, Orecchioni A, Piscioneri F, Guarracino F, Greco E, Peruzzi M, Biondi-Zoccai G, Frati G, Romano SM. Heart rate reduction with esmolol is associated with improved arterial elastance in patients with septic shock: a prospective observational study. Intensive Care Med. 2016 Oct;42(10):1528-1534. doi: 10.1007/s00134-016-4351-2. Epub 2016 Apr 21. PMID: 27101380
- Persona P, Tonetti T, Valeri I, Pivetta E, Zarantonello F, Pettenuzzo T, De Cassai A, Navalesi P. Dynamic Arterial Elastance to Predict Mean Arterial Pressure Decrease after Reduction of Vasopressor in Septic Shock Patients. Life (Basel). 2022 Dec 22;13(1):28. doi: 10.3390/life13010028. PMID: 36675977; PMCID: PMC9862728.