Il posizionamento del catetere arterioso periferico è ad oggi una delle procedure più utilizzate nei reparti di terapia intensiva e sale operatorie. Solitamente posizionato in arteria radiale con tecnica blind, spesse volte diventa sia per l’operatore che per il paziente più un problema che una risorsa.
Se ben posizionato e funzionante (accuratezza nella lettura della forma d’onda con segnale stabile anche dopo il flush senza necessità di alcuna mobilizzazione o stabilizzazione dell’arto), invece, aiuta ad ottimizzare il carico di lavoro di medici ed infermieri, facilita i prelievi di sangue e fornisce un accurato e continuo monitoraggio emodinamico.
Come ottimizzare il segnale pressorio attraverso un corretto accesso arterioso
Adottare un approccio proattivo al posizionamento di un accesso arterioso andrà a ridurre i fenomeni di risonanza e smorzamento che potrebbero condizionare le scelte terapeutiche fatte sul principio del Gold Directed Therapy [1].
Come suggeriscono anche le linee guida SIAARTI sulla ‘gestione emodinamica perioperatoria del paziente adulto in chirurgia non cardiaca’, la somministrazione di fluidi e vasopressori dovrebbero essere basati sui valori di indice cardiaco (CI), variazione dello stroke volume (SVV), variazione della pressione di picco (PPV), apporto di O2 (DO2), resistenze vascolari periferiche (SVR).. e non solamente dai tradizionali segni vitali [2].
Mentre fino a qualche anno fa queste informazioni erano di difficile rilevazione in quanto richiedevano devices molto più invasivi, ad oggi esistono tecnologie all’avanguardia e meno invasive che si basano sull’analisi della forma dell’onda di pressione arteriosa: pulse contour method.
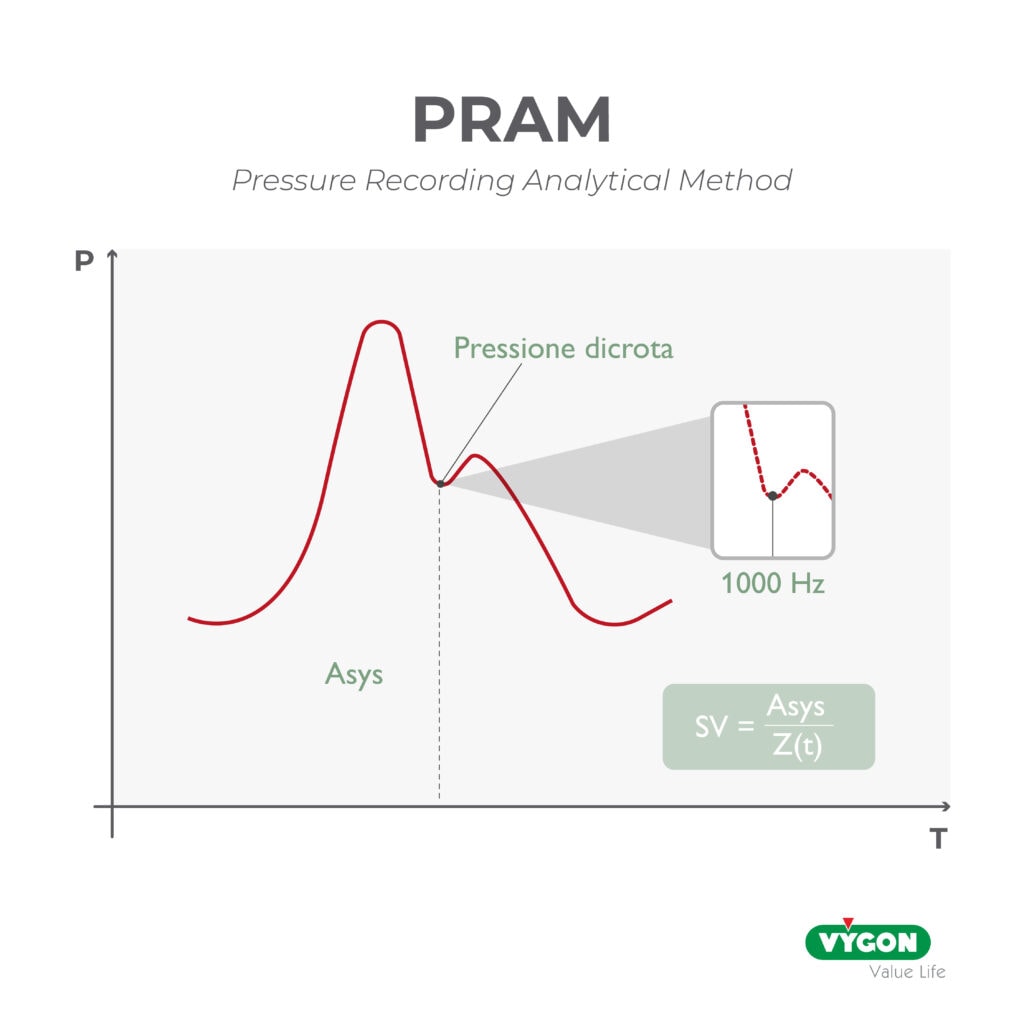
Si fa presto quindi a capire quanto sia importante se non fondamentale avere una forma d’onda più ‘pulita’ e realistica possibile.
Arteria radiale: come eseguire un corretto posizionamento
Anatomia dell’arteria radiale
L’arteria radiale può avere a volte anomalie anatomiche, essere tortuosa, collassabile e mobile, tutto ciò può influire sul tasso di insuccesso solitamente <10% ma che può raggiungere anche il 50% in pz in stato di shock. Ripetute punture oltre a far perdere del tempo, possono essere causa di discomfort per il paziente, aumentare il rischio di ematomi e causare spasmi all’arteria, rendendo ancora più difficile il suo incannulamento.
L’utilizzo dell’eco riduce del 32% l’insuccesso dell’incannulazione al primo tentativo e del 61% la formazione di ematoma [3].

Eco-guida e AIM method
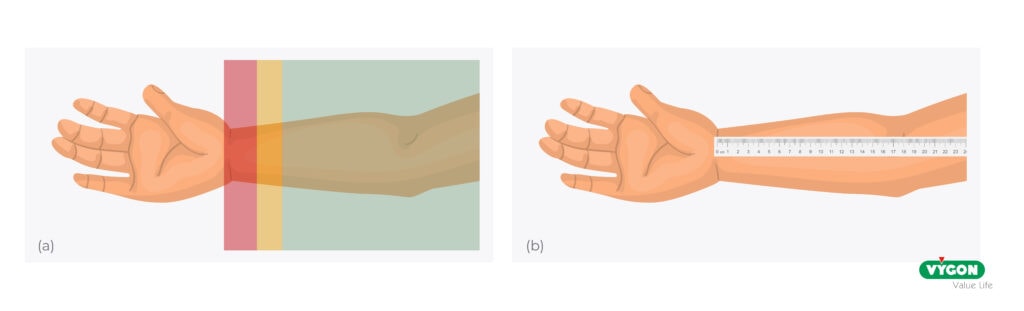
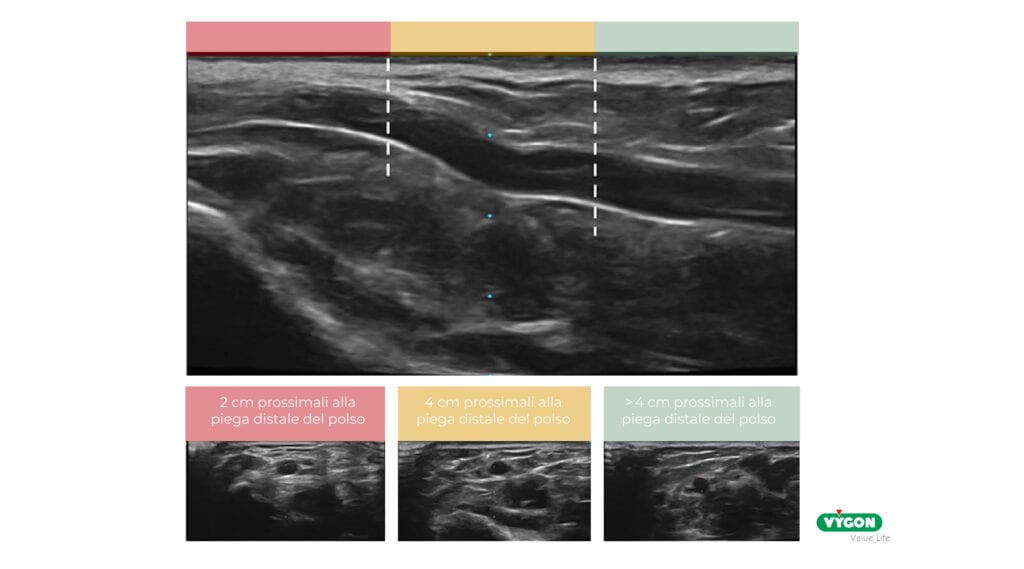
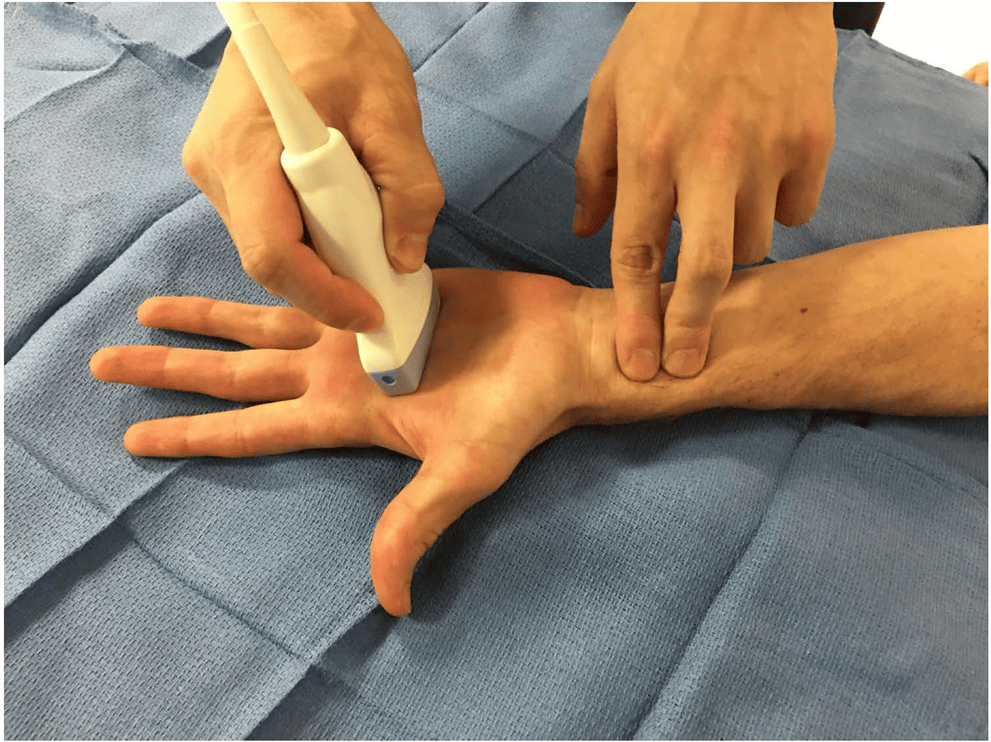
L’utilizzo della guida ecografica per la cateterizzazione dell’arteria radiale, oltre a preservare la salute del vaso, può supportarci anche nella scelta della zona da pungere. A questo scopo l’AIM (arterial insertion method) può fare al caso nostro promuovendo un approccio sistematico che prevede l’utilizzo di un ecografo per valutare l’arteria radiale ad una distanza di circa 4cm dal polso, nella zona conosciuta come ‘Chi’ (Cheok) in cui l’arteria è più grande, profonda e distante dall’articolazione [4].
Questa zona essendo lontana dall’articolazione è meno influenzata dal movimento ed offre maggior spazio per il fissaggio, il che ci garantisce maggior stabilità dell’accesso con conseguente riduzione di complicanze meccaniche ed infettive, preservando la performance del catetere e di conseguenza la sua vita [4-5].
Test di Allen
Prima del posizionamento della cannula arteriosa periferica radiale è importante valutare il circolo collaterale. Il metodo più utilizzato è il Test di Allen che nonostante i suoi limiti (soggettivo, range di riperfusione elevato (5-15sec), non applicabile in pz non collaboranti), risulta comparabile al Barbeau test ed al controllo con gli ultrasuoni.
Sta quindi all’operatore la scelta su quale utilizzare ma è consigliabile, in caso di Allen dubbio, il controllo con eco color doppler [6]
Come scegliere il corretto device arterioso
Oltre alle valutazioni relative all’anatomia dell’arteria radiale ed a quale sia il migliore approccio, è fondamentale tenere in considerazione anche alcuni aspetti legati alla scelta del dispositivo da utilizzare.
Infatti, materiale, calibro e lunghezza sono altri fattori che influenzano la durata e la performance del sistema di lettura.
· Materiale
Un materiale troppo termosensibile (poliuretano PUR) tenderà a modificare la propria struttura, troppo rigido (teflon PTFE) tenderà a rompersi. Il polietilene (PE) potrebbe essere l’ideale per il monitoraggio emodinamico in quanto essendo un materiale intermedio per le sue proprietà di durezza e memoria permette di mantenere nel tempo una buona trasmissione dell’onda pressoria arteriosa.
· Lunghezza e calibro
In base alla formula del coefficiente di assorbimento, un catetere troppo lungo contribuirà a smorzare la forma d’onda mentre un catetere troppo corto tenderà a dislocarsi più facilmente.
Stessa cosa riguardo il calibro, più grande è meglio, ma troppo occluderà il flusso arterioso con conseguente trombosi ed ipoperfusione dell’arto [7].
Il giusto compromesso risulta essere una lunghezza tale da garantire il 65% del catetere all’interno del vaso [8] e un calibro tale da non occludere più del 45% del lume del vaso [9-10].

· Tecnica di inserzione
Per quanto riguarda la tecnica di inserzione, nonostante vari autori indicano di mantenere un angolo tra 45° e 30° è consigliabile, solitamente con l’aiuto di una guida ecografica con puntura in plane asse lungo, adottare un’angolazione minore (tra 15° e 30°) così da aumentare il tratto sottocutaneo prima dell’ingresso nel vaso, tale da rendere il catetere più stabile con conseguente riduzione di complicanze meccaniche ed infettive [11]. Da evitare comunque l’inserzione del catetere con un angolo >45° in quanto si aumenterebbe il rischio di kinking con conseguente riduzione di accuratezza nel monitoraggio emodinamico.
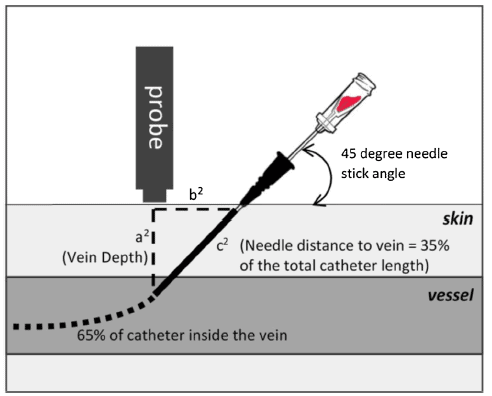
*Used with permission from Imbrìaco et al. [18]
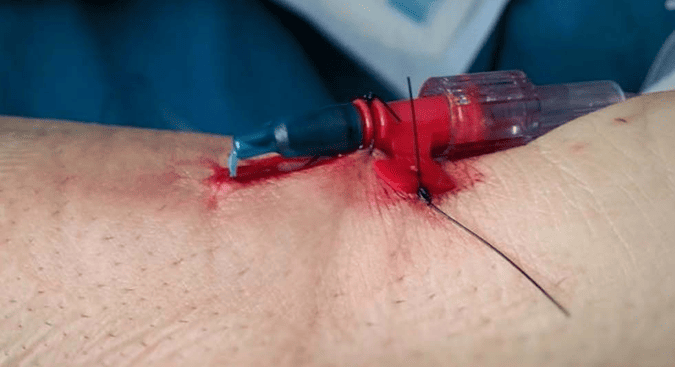
*Used with permission from Imbrìaco et al. [18]
Come ridurre al minimo il rischio di sposizionamento
Ultimo punto da non sottovalutare una volta posizionato il catetere è il rischio di rimozione accidentale e dislocamento. Basti pensare che del 20,4% dei cateteri rimossi accidentalmente il 65,3% ha richiesto il riposizionamento per poter continuare la terapia o monitoraggio [12].
La principale causa è imputabile ad inadeguata medicazione e stabilizzazione per la quale da sempre vengono utilizzati i più svariati metodi, da punti di sutura a cerotto (sterili e non), da sutureless devices a medicazioni in film di poliuretano.
Mentre le suture non sono più considerate un appropriato metodo di fissaggio ed il loro approccio è considerato ormai una pratica obsoleta in quanto associate a sanguinamento, rischio di puntura da parte dell’operatore, ripetuti cambi di medicazione, crescita di biofilm ed aumentato rischio di infezione del sangue associata a catetere [9-13], una recente revisione non ha trovato prove a sufficienza per suggerire un fissaggio rispetto ad un altro, se non l’utilizzo di una medicazione trasparente semipermeabile in poliuretano che permetta la visualizzazione del punto di inserzione [14].
Da valutare invece l’utilizzo di colla cianoacrilato per i suoi vari benefici (riduce il sanguinamento, stabilizza il catetere, riduce il rischio di infezione) [15-16-17].
La funzionalità e l’affidabilità del dispositivo arterioso sono essenziali per garantire l’accuratezza del monitoraggio emodinamico continuo, consentire frequenti prelievi ematici, evitare disagi e dolore al paziente, ottimizzare il carico di lavoro degli operatori sanitari.
Ad oggi la guida ecografica risulta essere lo standard che assieme alle strategie cliniche sopra elencate fornisce all’operatore elementi diretti e di facile applicazione definiti dall’acronimo RADIALS [18], protocollo descritto nello studio Imbrìaco et al., che estendono l’effettiva durata del presidio riducendo al contempo le complicanze prevenibili.

*Used with permission from Imbrìaco et al. [18]
PRODOTTI CORRELATI
BIBLIOGRAFIA
- Chong MA, Wang Y, Berbenetz NM, McConachie I. Does goal-directed haemodynamic and fluid therapy improve peri-operative outcomes?: A systematic review and meta-analysis. Eur J Anaesthesiol. 2018 Jul;35(7):469-483. doi: 10.1097/EJA.0000000000000778. PMID: 29369117.
- De Rosa, Rosanna. (2022). LINEE GUIDA Gestione emodinamica perioperatoria del paziente adulto in chirurgia non cardiaca LINEA GUIDA 2022.
- Wang A, Hendin A, Millington SJ, Koenig S, Eisen LA, Shiloh AL. Better With Ultrasound: Arterial Line Placement. Chest. 2020 Mar;157(3):574-579. doi: 10.1016/j.chest.2019.08.2209. Epub 2019 Oct 18. PMID: 31634448.
- Bardin-Spencer AJ, Spencer TR. Arterial insertion method: A new method for systematic evaluation of ultrasound-guided radial arterial catheterization. J Vasc Access. 2021 Sep;22(5):733-738. doi: 10.1177/1129729820944104. Epub 2020 Sep 28. PMID: 32985342.
- Gravante F, Lombardi A, Gagliardi AM, Pucci A, Latina R. Dressings and Securement Devices of Peripheral Arterial Catheters in Intensive Care Units and Operating Theaters: A Systematic Review. Dimens Crit Care Nurs. 2020 Sep/Oct;39(5):242-250. doi: 10.1097/DCC.0000000000000433. PMID: 32740194.
- Kiang SC, Nasiri AJ, Strilaeff RR, Prasad VS, Bharadwaj AS, Miller PA, Abou-Zamzam AM Jr, Tomihama RT. Analysis of Subjective and Objective Screening Techniques as Predictors of Safety for Radial Artery Intervention. Ann Vasc Surg. 2020 May;65:33-39. doi: 10.1016/j.avsg.2019.11.011. Epub 2019 Nov 11. PMID: 31726202.
- Romagnoli S, Ricci Z, Quattrone D, Tofani L, Tujjar O, Villa G, Romano SM, De Gaudio AR. Accuracy of invasive arterial pressure monitoring in cardiovascular patients: an observational study. Crit Care. 2014 Nov 30;18(6):644. doi: 10.1186/s13054-014-0644-4. PMID: 25433536; PMCID: PMC4279904.
- Pandurangadu AV, Tucker J, Brackney AR, Bahl A. Ultrasound-guided intravenous catheter survival impacted by amount of catheter residing in the vein. Emerg Med J. 2018 Sep;35(9):550-555. doi: 10.1136/emermed-2017-206803. Epub 2018 Jul 18. PMID: 30021833.
- Gorski LA, Hadaway L, Hagle ME, Broadhurst D, Clare S, Kleidon T, Meyer BM, Nickel B, Rowley S, Sharpe E, Alexander M. Infusion Therapy Standards of Practice, 8th Edition. J Infus Nurs. 2021 Jan-Feb 01;44(1S Suppl 1):S1-S224. doi: 10.1097/NAN.0000000000000396. PMID: 33394637.
- Spencer TR, Mahoney KJ. Reducing catheter-related thrombosis using a risk reduction tool centered on catheter to vessel ratio. J Thromb Thrombolysis. 2017 Nov;44(4):427-434. doi: 10.1007/s11239-017-1569-y. PMID: 29022210.
- Li X, Fang G, Yang D, Wang L, Zheng C, Ruan L, Wang L. Ultrasonic Technology Improves Radial Artery Puncture and Cannulation in Intensive Care Unit (ICU) Shock Patients. Med Sci Monit. 2016 Jul 11;22:2409-16. doi: 10.12659/msm.896805. PMID: 27397118; PMCID: PMC4954160.
- Galazzi A, Adamini I, Consonni D, Roselli P, Rancati D, Ghilardi G, Greco G, Salinaro G, Laquintana D. Accidental removal of devices in intensive care unit: An eight-year observational study. Intensive Crit Care Nurs. 2019 Oct;54:34-38. doi: 10.1016/j.iccn.2019.06.002. Epub 2019 Jun 22. PMID: 31235215.
- O’Grady NP, Alexander M, Burns LA, Dellinger EP, Garland J, Heard SO, Lipsett PA, Masur H, Mermel LA, Pearson ML, Raad II, Randolph AG, Rupp ME, Saint S; Healthcare Infection Control Practices Advisory Committee (HICPAC). Guidelines for the prevention of intravascular catheter-related infections. Clin Infect Dis. 2011 May;52(9):e162-93. doi: 10.1093/cid/cir257. Epub 2011 Apr 1. PMID: 21460264; PMCID: PMC3106269.
- Kim JU, Lee YJ, Lee J, Kim JY. Differences in the Properties of the Radial Artery between Cun, Guan, Chi, and Nearby Segments Using Ultrasonographic Imaging: A Pilot Study on Arterial Depth, Diameter, and Blood Flow. Evid Based Complement Alternat Med. 2015;2015:381634. doi: 10.1155/2015/381634. Epub 2015 Feb 11. PMID: 25763090; PMCID: PMC4339866.
- Prince D, Solanki Z, Varughese R, Mastej J, Prince D. Antibacterial effect and proposed mechanism of action of a topical surgical adhesive. Am J Infect Control. 2018 Jan;46(1):26-29. doi: 10.1016/j.ajic.2017.07.008. Epub 2017 Aug 24. PMID: 28844382.
- Gilardi E, Piano A, Chellini P, Fiori B, Dolcetti L, Pittiruti M, Scoppettuolo G. Reduction of bacterial colonization at the exit site of peripherally inserted central catheters: A comparison between chlorhexidine-releasing sponge dressings and cyano-acrylate. J Vasc Access. 2021 Jul;22(4):597-601. doi: 10.1177/1129729820954743. Epub 2020 Sep 4. PMID: 32883154.
- Nicholson J, Hill J. Cyanoacrylate tissue adhesive: a new tool for the vascular access toolbox. Br J Nurs. 2019 Oct 24;28(19):S22-S28. doi: 10.12968/bjon.2019.28.19.S22. PMID: 31647725.
- Imbrìaco G, Monesi A, Spencer TR. Preventing radial arterial catheter failure in critical care – Factoring updated clinical strategies and techniques. Anaesthesia Critical Care & Pain Medicine. 2022 Aug 1;41(4):101096. doi: 10.1016/j.accpm.2022.101096. Epub 2022 Apr 28. PMID: 35490863.