Nei pazienti che presentano un’ipovolemia grave o che sono in uno stato di shock ipovolemico, un ritardo nell’attuazione di una terapia fluidica può provocare lesioni ischemiche e shock irreversibile fino ad una insufficienza multiorgano come risultato di una inadeguata perfusione dei tessuti. Risulta chiara quindi la necessità di poter accedere facilmente alle informazioni riguardanti il quadro emodinamico del paziente in qualsiasi momento.
DI COSA TRATTA QUESTO ARTICOLO?
Questo articolo ha l’obiettivo di aiutare nell’individuazione dei primi segnali di ipovolemia e di indicare come intervenire in modo tempestivo.
1. Protocollo terapeutico GDT “Goal Directed Therapy”
La GDT permette di effettuare un uso più appropriato e mirato dei fluidi, dei vasopressori e dei farmaci inotropi, garantendo così una prognosi migliore e un recupero più rapido.
2. Sistema di monitoraggio e parametri emodinamici importanti.
Un paziente in stato di ipovolemia richiede un’azione immediata per evitare rischi per la sua vita, è importante quindi adottare un sistema di monitoraggio emodinamico in grado di visualizzare in tempo reale i parametri emodinamici, consentendo così di identificare qualsiasi alterazione fisiologica del paziente ed essere guidati durante la terapia. In questi pazienti, oltre ai classici parametri di gittata cardiaca (CO), stroke volume (SV) e di pressione, è importante poter valutare la variazione della pressione di polso (PPV), la variazione dello stroke volume (SVV), l’elastanza arteriosa (Ea) e l’efficienza del ciclo cardiaco (CCE).
Le complicanze intraoperatorie e postoperatorie in pazienti chirurgici ad alto rischio e i relativi outcome indesiderati avvengono in una percentuale significativa dei ricoveri in terapia intensiva e costituiscono una delle principali cause dell’aumento dei giorni di degenza e dei costi per la struttura ospedaliera. Infatti, lo stress chirurgico rappresenta uno dei fattori importanti che influenzano il risultato perioperatorio dovuto ad un aumento della domanda di ossigeno.
Nel 2008 è stato stimato che in tutto il mondo sono state eseguite circa 230 milioni di procedure chirurgiche, con un numero significativo di questi pazienti a rischio di complicazioni intraoperatorie o post-operatorie. Nonostante le procedure eseguite su pazienti ad alto rischio rappresentassero solo il 15% di quelle totali, tali pazienti hanno rappresentato l’80% dei decessi totali.
Nei pazienti critici durante gli interventi chirurgici possono infatti verificarsi cambiamenti emodinamici inaspettati. L’ipovolemia è stata identificata come la causa più comune di scompenso cardiaco in sala operatoria.
Pertanto, tutte le attività e le procedure volte a ridurre questi rischi non solo ridurranno i costi sanitari ma contribuiranno soprattutto ad aumentare la sicurezza del paziente.
CAUSE DI SHOCK IN SALA OPERATORIA
Gli stati di shock hanno molteplici cause, ma tutti comportano un’ipoperfusione degli organi vitali che, se non gestita rapidamente e in modo appropriato, può portare all’insufficienza d’organo e alla morte.
Lo shock presenta un tasso di mortalità del 20% e richiede un trattamento immediato in quanto può peggiorare molto rapidamente.
L’insufficienza cardiovascolare, o shock, può essere causata da:
- Problemi cardiaci: shock cardiogeno.
- Basso volume di sangue e fluidi: shock ipovolemico emorragico e non emorragico.
- Reazione allergica: shock anafilattico.
- Infezione: shock settico.
- Danni al sistema nervoso: shock neurologico.
Se lo shock è scompensato, la pressione arteriosa media o la portata cardiaca saranno inadeguate per garantire una corretta perfusione periferica. Nello shock compensato, la perfusione sarà adeguata, ma a spese del cuore che dovrà svolgere un lavoro maggiore. A seconda del tipo e della gravità dell’insufficienza cardiovascolare e della risposta al trattamento, lo shock può danneggiare diversi comparti anatomici.
IPOVOLEMIA
L’ipovolemia è la causa più comune di scompenso cardiaco in sala operatoria.
A fronte di piccole diminuzioni del volume del sangue (<15%), l’organismo mette in atto una serie di meccanismi di compenso (come l’aumento della pressione arteriosa e della frequenza cardiaca) in modo che il cuore possa continuare ad eiettare l’adeguata quantità di sangue così da non compromettere la perfusione e l’ossigenazione tissutale.
Quando si verificano perdite maggiori, il corpo perde la sua capacità di compensare, o la sua capacità di compensare è insufficiente, e il paziente va in shock.
LE CAUSE PRINCIPALI DELLO SHOCK IPOVOLEMICO SONO:
- Perdita di sangue significativa (shock emorragico).
- Perdita di acqua ed elettroliti (sodio e potassio).
- Perdita di plasma.
L’ipotensione rappresenta uno degli indicatori di ipovolemia, ma per avere accesso ad altri parametri che possano indicare uno stato di ipovolemia o la risposta del paziente al trattamento, è necessario l’aiuto di un monitor avanzato che mostri i cambiamenti emodinamici in tempo reale.
COME PREVENIRE L’IPOVOLEMIA?
Di fronte a un paziente in shock ipovolemico, l’obiettivo è quello di controllare la perdita di fluidi e di sangue, reintegrare ciò che è stato perso e stabilizzare il danno causato dallo shock ipovolemico il più presto possibile.
La rianimazione con liquidi per via endovenosa rimane l’intervento più comune per i pazienti in situazioni critiche. C’è stato molto dibattito su quali fluidi endovenosi utilizzare per la rianimazione, tuttavia, attualmente le soluzioni cristalloidi rimangono lo Standard of Care.
Dopo aver stabilito la tipologia di fluidi da somministrare e fissato un obiettivo terapeutico, è necessario monitorare i progressi del paziente per controllarne la risposta e regolare il trattamento di conseguenza.
E’ molto importante avere a disposizione le informazioni in tempo reale poiché nei pazienti con grave ipovolemia o shock ipovolemico un ritardo nell’effettuare la fluidoterapia può provocare lesioni ischemiche e shock irreversibile con conseguente insufficienza multiorgano.
Pertanto, al fine di identificare i segni precoci di ipovolemia, e di agire tempestivamente in caso di ipovolemia, dobbiamo:
- Eseguire una fluidoterapia mirata.
- Disporre di un sistema di monitoraggio che permetta di conoscere in tempo reale le variabili emodinamiche sia classiche che avanzate, per poter identificare qualsiasi alterazione delle condizioni del paziente e servire da guida durante la terapia.
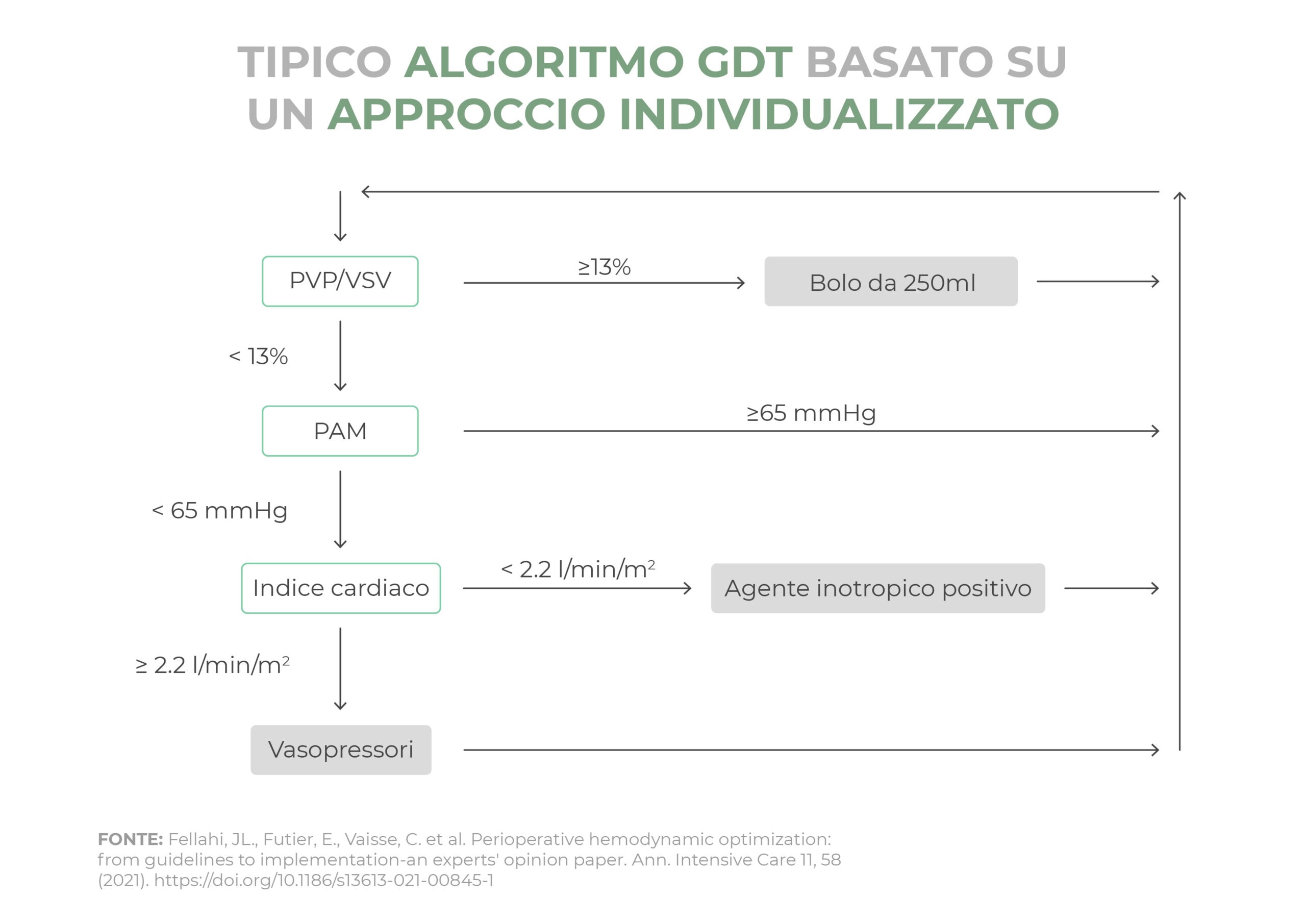
Protocollo terapeutico GDT “Goal Directed Therapy”
La terapia emodinamica perioperatoria Goal Directed Therapy (GDT) o “ottimizzazione emodinamica” è una strategia di monitoraggio e intervento sui parametri fisiologici con l’obiettivo di migliorare la gittata cardiaca (CO) e il trasporto di ossigeno (DO2) per prevenire o compensare il prima possibile il debito di ossigeno. Inoltre, permette un uso più appropriato di fluidi, vasopressori e inotropi e per questo offre una prognosi migliore e un recupero più rapido.
È stato dimostrato che la Terapia Perioperatoria Goal Directed Therapy (PGDT) può migliorare l’esito post-operatorio nei pazienti chirurgici ad alto rischio. Infusioni inappropriate di agenti vasopressori possono portare ad un aumento dell’ipoperfusione e dell’ischemia dell’organo; viceversa la somministrazione eccessiva di fluidi è stata associata ad un aumento delle complicazioni, a una maggiore degenza in ospedale e nell’unità di terapia intensiva (UTI) e a un incremento di mortalità.
Monitoraggio in tempo reale
Il monitoraggio emodinamico determina, in larga misura, l’efficacia del trattamento. Tra i vari sistemi avanzati di monitoraggio emodinamico, i più utilizzati nei pazienti ad alto rischio sono quelli che analizzano il contorno del polso dell’onda di pressione arteriosa (PCM) per la stima del volume sistolico.
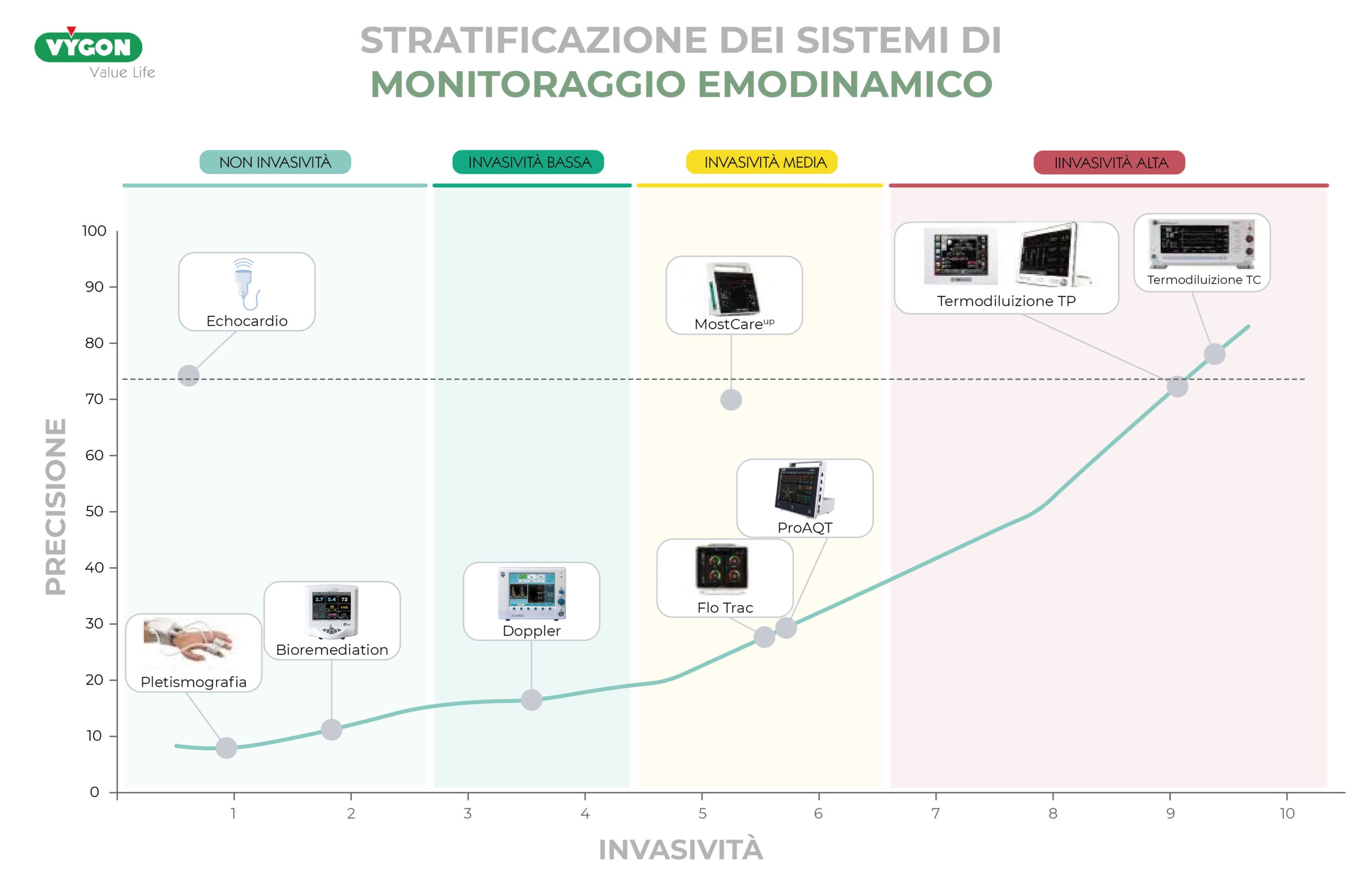
Esistono differenti tipi di sistemi di monitoraggio disponibili: l’invasività e la precisione sono due aspetti imprescindibili nella scelta del sistema più appropriato, e sono strettamente consequenziali al modo in cui il sistema raccoglie le informazioni.
I sistemi di monitoraggio emodinamico che utilizzano le leggi della fisica classica (legge di Otto Frank e legge di Stewart Hamilton) risultano più precisi rispetto a quelli basati su metodi statistici (Langewouters, curtosi). In quest’ultimi, basandosi su dati prestabiliti e non tenendo conto delle differenze emodinamiche individuali, la precisione risulta inevitabilmente bassa.
Come abbiamo visto, nel caso di pazienti in ipovolemia, il fattore tempo gioca un ruolo fondamentale. Pertanto, la semplicità o la complessità di collegamento del sistema, la frequenza di campionamento, la necessità o meno di calibrazione per ogni possibile variazione dei parametri e la disponibilità immediata, battito per battito, dell’informazione emodinamica sono punti chiave da prendere in considerazione, poiché la risposta del paziente può essere imprevedibile e variare in pochi istanti.
Parametri emodinamici
Per identificare e agire sui segni precoci dell’ipovolemia, è importante avere a disposizione un sistema che visualizzi diversi parametri emodinamici standard e avanzati in tempo reale.
Variazione della pressione del polso (PPV) e variazione del volume sistolico (SVV)
Di fronte a stati, o possibili stati, di ipovolemia, i parametri emodinamici dinamici saranno più accurati nel determinare l’eziologia e la risposta del paziente alla somministrazione dei fluidi.
In questi pazienti, infatti, oltre ai classici parametri di portata cardiaca (CO), gittata sistolica (SV) o di pressione, sono anche molto utili la variazione della pressione del polso (PPV) e la variazione del volume sistolico (SVV).
Sia PPV che SVV sono considerati predittori affidabili per misurare la risposta della gittata cardiaca all’infusione di fluidi e permetteranno di seguire da vicino l’evoluzione del trattamento somministrato. È importante sottolineare che ciò è valido solo in determinate condizioni specifiche, in particolare per i pazienti in ventilazione meccanica, in assenza di respirazione spontanea e in ritmo sinusale normale.
Elastanza dinamica (PPV/SVV)
L’elastanza dinamica (PPV/SVV) è il rapporto tra la variazione della pressione di polso (PPV) e la variazione dello stroke volume (SVV) durante un singolo respiro a pressione positiva. Questo parametro ci permetterà di valutare il tono arterioso dinamico.
Elastanza arteriosa (Ea)
Un altro parametro interessante nella valutazione e nella prevenzione dell’ipovolemia è l’elastanza arteriosa (Ea), cioè il rapporto tra le variazioni di pressione telesistolica e le variazioni di volume sistolico, analizzato da un punto di vista dinamico. Questo parametro è principalmente legato all’elasticità del sistema arterioso.
L’elasticità delle grandi arterie permette a questi vasi di espandersi durante la fase di eiezione, accogliendo più sangue e garantendo così il flusso sanguigno diastolico in periferia durante la diastole. Questa proprietà arteriosa consente di convertire il flusso pulsante in uno continuo in base alle resistenze vascolari degli organi.
Più rigidi sono i vasi, minore è il volume e quindi maggiore è l’Ea. In altre parole, fornisce informazioni sul carico arterioso imposto al ventricolo sinistro ad ogni battito.
Efficienza del ciclo cardiaco (CCE)
Infine, anche l’efficienza del ciclo cardiaco (CCE) sarebbe utile in quanto fornisce informazioni sulla quantità di energia spesa dal sistema cardiovascolare per espellere il sangue ad ogni sistole.
Quindi… quanto è importante il fattore tempo nei pazienti in ipovolemia?
Come abbiamo visto, nei pazienti con ipovolemia, un ritardo nella somministrazione di fluidi può causare:

- Ipovolemia grave o shock ipovolemico.
- Lesione ischemica.
- Shock irreversibile con insufficienza multiorgano.
- Aumento della degenza ospedaliera e nelle unità di terapia intensiva.
- Aumento della mortalità.
Avere a disposizione un monitor semplice da collegare, senza bisogno di una calibrazione continua e capace di visualizzare i parametri emodinamici classici e avanzati in tempo reale fornisce al professionista l’agilità e l’immediatezza necessarie per rispondere più rapidamente ed evitare che il paziente vada incontro a un peggioramento delle proprie condizioni cliniche.
PRODOTTI CORRELATI
BIBLIOGRAFIA
- Aseni, P., Orsenigo, S., Storti, E. et al. Concetti attuali di monitoraggio perioperatorio nei pazienti chirurgici ad alto rischio: una revisione. Patient Saf Surg 13, 32 (2019). https://doi.org/10.1186/s13037-019-0213-5
- Pinsky, M. R., Wertz, A., Clermont, G., & Dubrawski, A. (2020). Parsimonia dei dati di monitoraggio emodinamico sufficiente per il rilevamento dell’emorragia. Anestesia e analgesia, 130(5), 1176-1187. https://doi.org/10.1213/ANE.0000000000004564
- Mandel, J., Palevsky, P.M., (2021) Treatment of severe hypovolemia or hypovolemic shock in adults. Ed. Sterms, R.H., Manaker, S., Finlay, G. https://www.uptodate.com/contents/treatment-of-severe-hypovolemia-or-hypovolemic-shock-in-adults
- Taghavi S, Askari R. Hypovolemic Shock. [Updated 2021 Jul 20]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 Jan-.
- Moranville MP, Mieure KD, Santayana EM. Valutazione e gestione degli stati di shock: Shock ipovolemico, distributivo e cardiogeno. Giornale di pratica farmaceutica. 2011;24(1):44-60. doi:10.1177/0897190010388150
- Jacob L. Heller, MD, MHA, Emergency Medicine, Emeritus, Virginia Mason Medical Center, Seattle, WA. Anche rivisto da David Zieve, MD, MHA, direttore medico, Brenda Conaway, direttore editoriale, e l’A.D.A.M. (2019). Shock. https://medlineplus.gov/spanish/ency/article/000039.htm
- Marik, P.E., Monnet, X. & Teboul, JL. Parametri emodinamici per guidare la terapia dei fluidi. Ann. Intensive Care 1, 1 (2011). https://doi.org/10.1186/2110-5820-1-1
- Nall, R. M. (2018, 17 septiembre). Shock ipovolemico. Healthline. https://www.healthline.com/health/hypovolemic-shock
- Melendez Rivera JG, Anjum F. Ipovolemia. . In: StatPearls . Isola del tesoro (FL): StatPearls Publishing; 2021 Jan-. Disponibile da: https://www.ncbi.nlm.nih.gov/books/NBK565845/
- Urbano J, López J, González R, Fernández SN, Solana MJ, Toledo B, Carrillo Á, López-Herce J. Confronto tra il metodo analitico di registrazione della pressione (PRAM) e il metodo di termodiluizione arteriosa femorale (FATD) monitoraggio della portata cardiaca in un modello animale infantile di arresto cardiaco. Intensive Care Med Exp. 2016 Dec;4(1):13. doi: 10.1186/s40635-016-0087-0. Epub 2016 Jun 3. PMID: 27256288; PMCID: PMC4891310.
- Gil Cano, A., Monge García, M., & Baigorri González, F. (2012). Evidencia de la utilidad de la monitorización hemodinámica en el paciente crítico. Medicina Intensiva, 650-655. https://doi.org/10.1016/j.medin.2012.06.004
- Mateu Campos, M., Ferrándiz Sellés, A., Gruartmoner De Vera, G., Mesquida Febrer, J., Sabatier Cloarec, C., Poveda Hernández, Y., & García Nogales, X. (2012b). Técnicas disponibles de monitorización hemodinámica. Ventajas y limitaciones. Medicina Intensiva. Pubblicato. https://doi.org/10.1016/j.medin.2012.05.003
- Teboul JL, Saugel B, Cecconi M, De Backer D, Hofer CK, Monnet X, Perel A, Pinsky MR, Reuter DA, Rhodes A, Squara P, Vincent JL, Scheeren TW. Monitoraggio emodinamico meno invasivo nei pazienti critici. Intensive Care Med. 2016 Sep;42(9):1350-9. doi: 10.1007/s00134-016-4375-7. Epub 2016 maggio 7. PMID: 27155605.
- Alonso-Iñigo JM, Escribá FJ, Carrasco JI, Fas MJ, Argente P, Galvis JM, Llopis JE. Misurazione della portata cardiaca nei bambini sottoposti a cateterismo cardiaco: confronto tra il metodo Fick e PRAM (metodo analitico di registrazione della pressione). Paediatr Anaesth. 2016 Nov;26(11):1097-1105. doi: 10.1111/pan.12997. Epub 2016 Aug 27. PMID: 27565740.
- Scolletta S, Romano SM, Biagioli B, Capannini G, Giomarelli P. Pressure recording analytical method (PRAM) for measurement of cardiac output during various haemodynamic states. Br J Anaesth. 2005 Aug;95(2):159-65. doi: 10.1093/bja/aei154. Epub 2005 maggio 13. PMID: 15894561.
- Scolletta, S., Romano, S. M., & Giomarelli, P. (2006). Monitoraggio emodinamico minimamente invasivo con il metodo analitico di registrazione della pressione. Annuario di terapia intensiva e medicina d’urgenza, 192-202. https://doi.org/10.1007/3-540-33396-7_19
- Sorbara, C., Romagnoli, S., Rossi, A., & Romano, S.M. (2007). Insufficienza circolatoria: Monitoraggio emodinamico funzionale a letto.
- Linee Guida SIAARTI- Gestione Emodinamica perioperatoria del paziente adulto in chirurgia non cardiaca- 2022