Sulla base dei risultati conseguiti dal protocollo ISALT è stato elaborato un protocollo, denominato ISALT 2 [15], che racchiude tutte le raccomandazioni necessarie, basate sulle evidenze cliniche e linee guida internazionali, necessarie a minimizzare l’incidenza di complicanze, aumentare la sicurezza e la costo-efficacia della manovra.
Tra le complicanze immediate o precoci che possono essere prevenute mediante una appropriata tecnica di impianto possiamo distinguere le complicanze strettamente legate alla venipuntura, quelle legate al passaggio della guida metallica (aritmie) e quelle legate alla progressione del catetere (malposizioni primarie). Il protocollo ISALT 2 è un bundle di 6 raccomandazioni (Tabella II) atte proprio alla prevenzione di tali complicanze.

1) Tecnica asettica accurata
Effettuare l’impianto in un ambiente pulito e sanificabile (sala operatoria o ambiente dedicato di day hospital o ambulatorio specialistico); prestare molta attenzione al lavaggio delle mani prima della procedura, utilizzando le massime protezioni di barriera per l’impianto, quali mascherina e cuffia non sterili, guanti sterili, camice sterile e ampio campo operatorio sterile; effettuare un’accurata antisepsi cutanea utilizzando preferenzialmente clorexidina 2% in soluzione di alcool isopropilico al 70% 35,36. (Fonte: CDC 2011)
Per quanto riguarda le massime protezioni di barriera, l’utilizzo di pack procedurali già composti ad hoc per l’impianto permette di abbattere notevolmente i costi e i tempi in quanto tutto il necessario è già racchiuso all’interno dello stesso pack e non si rischia di dimenticare nulla. Ciò funge anche da check list del materiale.
Inoltre, avere un unico pack interamente sterile permette di ridurre i rischi di contaminazione del materiale e dell’operatore durante le operazioni di reperimento del materiale e apertura delle varie singole confezioni.
(Fonte: “RISCHIO DI INFEZIONE CATETERE CORRELATE IN ICU: COME PREVENIRE” – Giancarlo Scoppettuolo, Fondazione Policlinico Universitario “A. Gemelli” ROMA).

2) Venipuntura centrale eco-guidata
La scelta della vena apparentemente più appropriata avviene previo esame ecografico del patrimonio venoso del paziente.
Esiste un protocollo specifico per l’analisi del patrimonio venoso del paziente e delle strutture circostanti detto RAPEVA (Rapid Peripheral Venous Assestment), analogo al protocollo RaCeVA (Rapid Central Venous Assessment) sviluppato alcuni anni fa per sistematizzare l’esame delle vene sopra-sottoclaveari prima di una venipuntura centrale, che consiste in un adeguato esame ecografico rapido delle vene centrali tale da permettere di studiare le opzioni disponibili (vene giugulare interna, anonima, succlavia, ascellare) e di scegliere la vena più facile e più adatta alla situazione.
Il protocollo RaPeVA prevede inizialmente l’identificazione delle principali vene e arterie della piega del gomito, poi lo studio della vena basilica, quindi del fascio nervo-vascolare costituito da nervo mediano, arteria brachiale e vene brachiali e infine della vena cefalica.
L’esame è completato dalla visualizzazione delle principali vene in sede sottoclaveare e poi sopraclaveare, allo scopo di identificare potenziali anomalie o alterazioni patologiche che possono essere di ostacolo alla progressione del catetere.
In breve, il protocollo RaPeVA prevede – in sequenza – la visualizzazione della vena cefalica alla piega del gomito, lo scorrimento della sonda dal lato radiale al lato ulnare fino a identificare l’arteria e le vene brachiali e la confluenza tra vena antecubitale e vena basilica, l’identificazione della vena basilica durante il suo decorso lungo il solco bicipito-omerale scorrendo la sonda dal basso verso l’alto, lo spostamento laterale della sonda per un esame del fascio nervo-vascolare del braccio e poi ancora più lateralmente per visualizzare la vena cefalica a tale livello, e infine un esame rapido delle vene cefalica e ascellare in sede sottoclaveare e delle vene giugulare interna, succlavia e anonima in sede sopraclaveare.
L’adozione sistematica del RaPeVA permette di analizzare le caratteristiche di tutte le vene del braccio potenzialmente interessanti per un corretto impianto di un PICC o di un Midline e si è rivelato particolarmente utile nella didattica GAVeCeLT riferita all’impianto di dispositivi brachiali di vario tipo (cannule lunghe, Midline, PICC, PICC tunnellizzati, CCT brachiali, PICC-port).

Se non controindicato da particolari condizioni anatomiche locali, si preferisce il lato destro (considerando che le vene centrali tendono a essere di maggior calibro sul lato destro e che l’incannulazione dal lato destro si associa a minor rischio di malposizioni e di trombosi venosa centrale da catetere). E’ altresì vero che è consigliabile preferire l’incannulazione delle vene dell’arto dominante, in quanto è il più utilizzato e pertanto presenta vasi solitamente di calibro maggiore.
L’utilizzo sistematico dell’ecografo ha ridotto in modo significativo tutte le altre complicanze legate alla venipuntura come, ad esempio, la puntura arteriosa accidentale.
La venipuntura eco-guidata, associandosi ad enormi benefici in termini di sicurezza, costo-efficacia ed efficienza, andrebbe adottata in modo assiduo e costante, nell’interesse del paziente, dell’operatore e dell’azienda ospedaliera. Molte trombosi venose centrali prossimali (ovvero generatesi presso il sito di venipuntura) sono legate a manovre traumatiche di puntura ripetuta della vena, con ematomi locali ed estesi danni endoteliali; le linee guida nazionali ed internazionali raccomandano l’adozione della venipuntura eco-guidata, quindi, anche per la riduzione di tale rischio.
Tecniche di venipuntura ecoguidata
Visualizzazione del vaso:
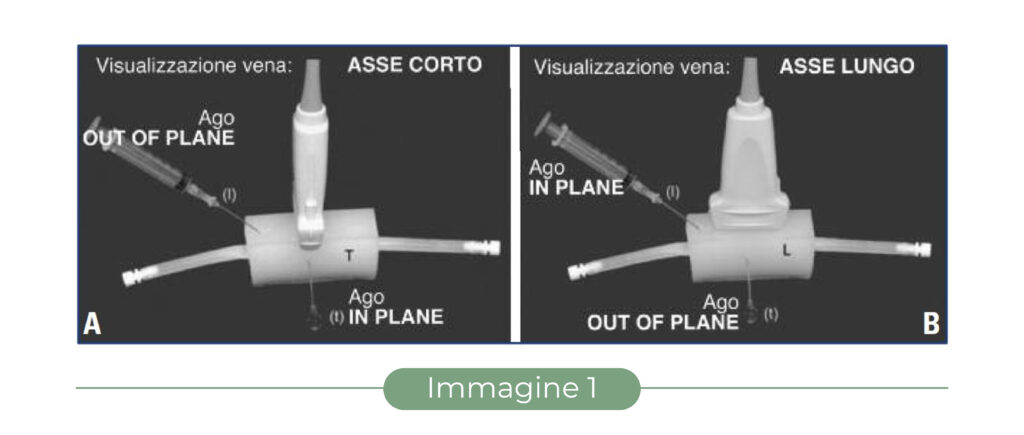
– posizionando la sonda in modo che il piano del fascio ultrasonoro sia perpendicolare all’asse della vena (Fig. 1A), si ottiene una sezione trasversale del vaso, che appare come una immagine anecogena circolare (“asse corto” – Fig. 2A). Questa scansione, più semplice da ottenere e mantenere anche per il principiante, garantisce una buona visione panoramica della vena e delle strutture circostanti, che rimangono sotto controllo durante tutta la procedura;
– posizionando la sonda in modo che il piano del fascio ultrasonoro sia parallelo all’asse della vena (Fig. 1B) si ottiene una sezione longitudinale del vaso, che appare come un’immagine anecogena tubulare (“asse lungo” – Fig. 2B). Questa scansione è più difficile da ottenere e mantenere, ma se associata alla puntura con ago “in plane” garantisce un perfetto controllo dell’ago in tutto il suo percorso nei tessuti.
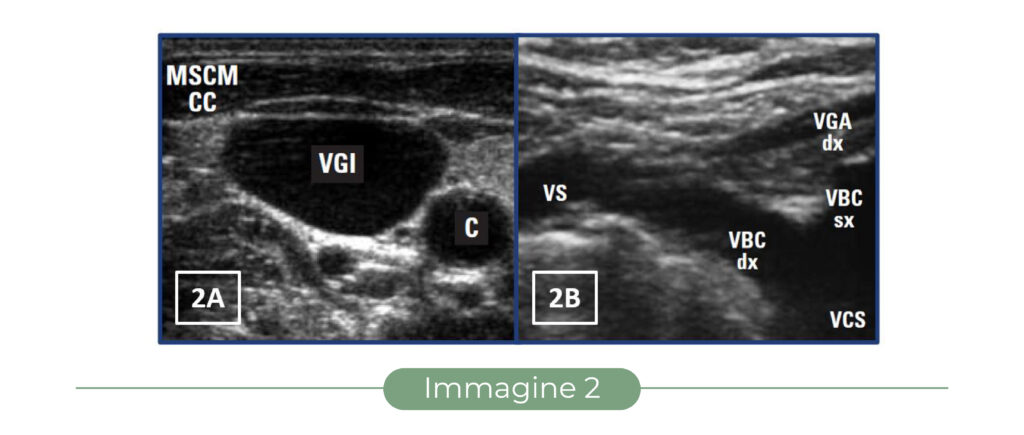
Visualizzazione dell’ago:
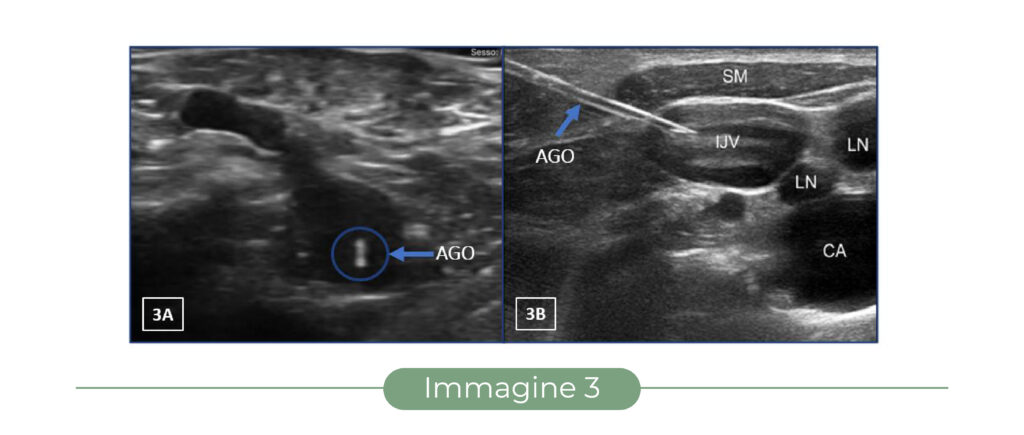
– se l’ago “perfora” il piano del fascio ultrasonoro, è visualizzabile solo nel momento del passaggio attraverso il piano stesso come uno “spot” iperecogeno, equivalente alla sezione traversa della punta (“out of plane” – Fig. 1 e Fig. 3A);
– se l’ago viene mantenuto nel piano del fascio ultrasonoro, è visualizzabile in tutta la sua lunghezza e in tutto il suo percorso nei tessuti (“in plane” – Fig. 1 e Fig. 3B).
Combinando la modalità di visualizzazione del vaso con la modalità di visualizzazione dell’ago otteniamo 4 tecniche di puntura eco-guidata:
- vena in asse corto + ago in plane;
- vena in asse corto + ago out of plane;
- vena in asse lungo + ago in plane;
- vena in asse lungo + ago out of plane;
Nella pratica clinica si utilizzano sostanzialmente tutte le opzioni tranne l’ultima.
Ecoanatomia delle vene dell’arto superiore [5]
Le vene superficiali e profonde dell’avambraccio e del braccio vengono usualmente visualizzate con ecografi dotati di sonde lineari di lunghezza compresa tra 26 e 38 mm, con frequenza superiore a 7 MHz e adatta quindi allo studio dei tessuti compresi tra superficie cutanea e 2-3 cm di profondità. La sonda deve essere orientata trasversalmente rispetto all’asse dell’arto e perpendicolarmente alla cute, con orientamento tale che la sinistra dell’operatore corrisponda alla sinistra della immagine sullo schermo ma alla destra del paziente. La sonda deve essere impugnata in modo saldo e stabile, senza esercitare eccessiva pressione sulla superficie cutanea. Poiché la maggior parte delle vene del braccio ha orientamento longitudinale, un orientamento trasversale della sonda comporta una visualizzazione delle vene in asse corto, consentendo una visione panoramica delle vene nei loro rapporti tra loro e con le altre strutture che decorrono longitudinalmente, quali le arterie e i nervi (Figura 4).
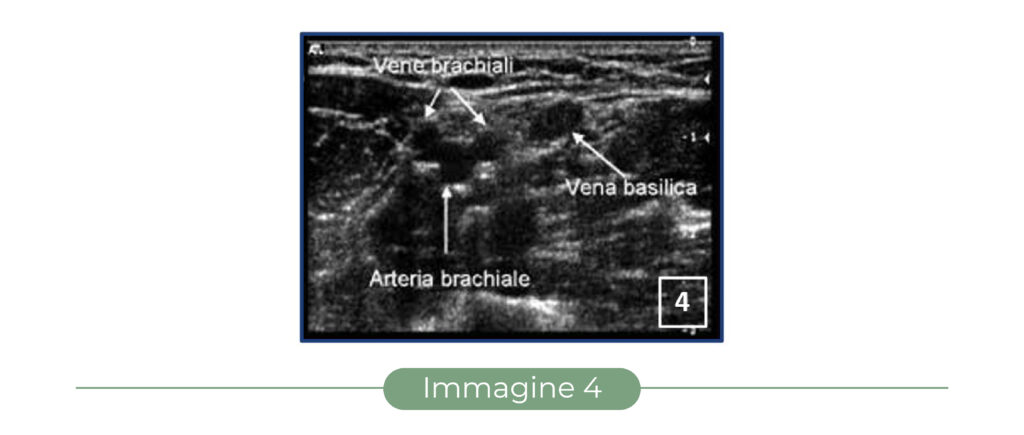
In asse corto, la vena appare ecograficamente come un’immagine grossolanamente rotonda e anecogena (scura), facilmente comprimibile sotto la pressione esercitata dalla sonda ecografica; un’immagine di tal tipo ma non comprimibile è da interpretare come un’arteria (se pulsante) o come una vena trombizzata o come una struttura non vascolare (se non pulsante). I nervi appaiono invece come strutture complesse, multiloculate (immagine ad “alveare”), prevalentemente iperecogene e non comprimibili.
Le vene dell’arto superiore potenzialmente interessanti ai fini della puntura e dell’incannulamento con tecnica ecoguidata non sono molte. La vena più lunga è la vena cefalica, che nasce in prossimità della cosiddetta “tabacchiera anatomica” sul margine radiale del polso e che decorre abbastanza superficiale per tutto l’avambraccio, dove può essere utilizzata per il posizionamento ecoguidato di agocannule o di cannule periferiche lunghe.
Poco prima della fossa antecubitale si stacca dalla vena cefalica un’importante collaterale, detta vena antecubitale, che sfocia poi nella vena basilica. In corrispondenza del gomito, la vena cefalica aumenta notevolmente di calibro (è la vena più tipicamente utilizzata a scopo di prelievi ematici) ma poi ridiventa sottile e decorre con traiettoria alquanto irregolare e superficiale sopra il muscolo bicipite, fino ad arrivare alla spalla e percorrere il solco deltoideo-pettorale, unendosi infine con la vena ascellare poco prima del passaggio di quest’ultima sotto la clavicola e al di sopra della prima costa.
In corrispondenza della piega del gomito la vena cefalica è grande, superficiale e facilmente incannulabile (spesso senza necessità di ecografo), ma trattandosi di una zona di flessione il posizionamento di un accesso venoso periferico in tale sede non è da considerare opportuno, tranne che in condizioni di emergenza.
A livello del braccio la vena cefalica è – come già detto – molto superficiale e può essere appropriata per il posizionamento ecoguidato di una cannula corta o di un “mini-Midline”, ma molto meno per il posizionamento di un PICC e ancora meno per un PICC-Port.
Lungo il margine ulnare dell’avambraccio decorre la vena basilica, solitamente più sottile della cefalica, anche se altrettanto superficiale; in questa sede può essere incannulata per via ecoguidata per il posizionamento di agocannule o cannule lunghe.
In prossimità della piega del gomito, la vena basilica riceve più affluenti (tra i quali la già descritta vena antecubitale e una vena retro-olecranica), fino a diventare di calibro assai rilevante (4-5 mm) nel suo decorso nel braccio, nella piega bicipito-omerale. È questo il tratto in cui la vena basilica, che tipicamente decorre a una profondità di 1-2 cm, ha le caratteristiche ideali per essere punta e incannulata per via ecografica.
Le sue dimensioni, la sua profondità e la lontananza da altre strutture arteriose e nervose (con la possibile eccezione del nervo cutaneo mediale del braccio, che però è spesso molto sottile e trascurabile) la rendono la vena di prima scelta per il posizionamento di un PICC o di un PICC-Port o anche di un Midline.
Nel suo decorso verso la parte alta del braccio, la vena basilica tende a spostarsi verso il fascio nervo-vascolare del braccio (costituito da arteria brachiale, vene brachiali e nervo mediano), che decorre appena al di sotto del margine mediale del muscolo bicipite.
La vena basilica, dopo aver ricevuto come affluenti tutte le vene brachiali, diventa poi vena ascellare e come tale entra nel cavo ascellare. Le vene brachiali sono in numero variabile da due a cinque e decorrono come vene satelliti dell’arteria brachiale. Quest’ultima, anche detta arteria omerale, è la principale e unica arteria del braccio, dividendosi nell’avambraccio – di solito 6-8 centimetri distalmente alla piega del gomito – in arteria radiale e arteria ulnare.
Le vene brachiali sono ben identificabili ecograficamente, nella maggior parte dei casi, soltanto a livello del braccio, dalla piega del gomito in su, e si manifestano come piccole immagini rotonde anecogene ben comprimibili poste ai due lati dell’arteria brachiale: l’immagine che ne risulta viene spesso descritta come quella della sagoma di “Mickey Mouse”, ove l’arteria sembra la testa e le due vene brachiali le orecchie (Figura 4).
Nell’ambito del braccio, le vene brachiali decorrono lungo il già descritto fascio nervo-vascolare, dal quale si separano – con modalità estremamente variabile e a livelli del braccio estremamente variabili – per confluire nella vena basilica.
Solitamente, il sistema venoso del versante ulnare del braccio (brachiali-basilica-ascellare) drena circa il 75% del sangue refluo dell’arto superiore, mentre la vena cefalica e le sue collaterali sul versante radiale drenano il restante 25%. Le vene brachiali pur essendo appropriate come profondità, hanno un calibro molto variabile (anche in funzione del loro numero, anch’esso assai variabile) e la loro puntura eco-guidata può essere meno semplice a causa degli stretti rapporti che stringono con l’arteria brachiale e con il nervo mediano.
3) Controllo intra-procedurale della posizione della punta del catetere mediante fluoroscopia o, preferibilmente, mediante il metodo dell’ECG intra-cavitario.
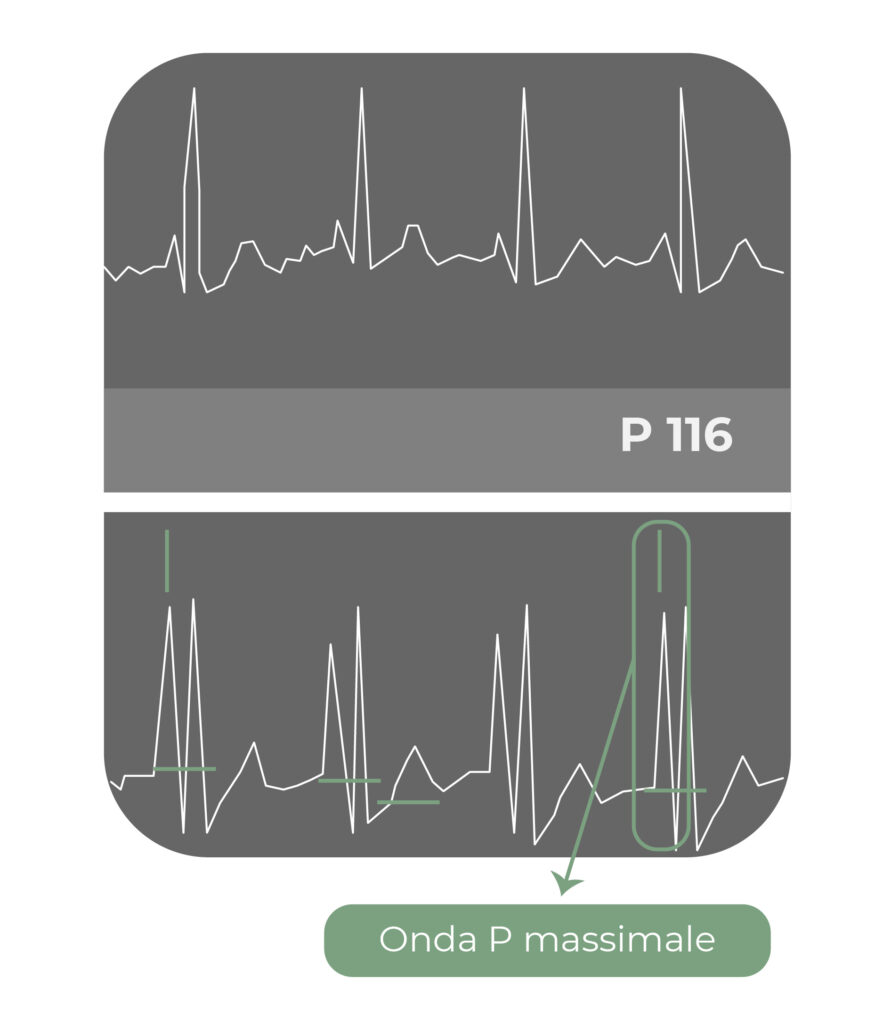
Quest’ultimo è un metodo semplice, accurato, ed economico, applicabile in quasi tutti i pazienti, tranne che in quelli in cui l’onda P non sia riconoscibile all’ECG di base come nei pazienti con pacemaker atriale attivo.
La punta di un catetere venoso centrale, a fine impianto, dovrebbe trovarsi nel tratto compreso tra il 1/3 inferiore della vena cava superiore e il 1/3 superiore dell’atrio destro, in corrispondenza della giunzione atriocavale. Dopo la venipuntura centrale vera e propria (ovvero dopo la puntura e l’incannulamento della vena giugulare interna, della vena succlavia, della vena ascellare o della vena anonima), possono verificarsi vari tipi di malposizioni primarie relativamente frequenti e potenzialmente associate ad ulteriori complicanze.

Il metodo dell’ECG intra-cavitario fu ideato nel lontano 1949 e usato diffusamente in Europa negli anni ’80 e ’90; è recentemente tornato alla ribalta per i suoi indubbi vantaggi in termini di semplicità, facilità di esecuzione, sicurezza, costo-efficacia e accuratezza rispetto alle manovre fluoroscopiche.
Il metodo, in particolare se attuato con la tecnica della colonna di soluzione fisiologica, può essere applicato in modo semplice ed efficace a qualsiasi accesso venoso centrale a lungo termine, e, qualora associato ad una metodica di venipuntura scevra di rischio di danno pleuropolmonare (come, ad esempio, la venipuntura eco-guidata), consente di omettere anche il controllo radiologico post-procedura. L’efficacia del metodo è stata dimostrata anche per gli accessi venosi a lungo termine.
Il meccanismo patogenetico più tipico delle trombosi venose centrali distali (ovvero quelle che insorgono in prossimità della punta del catetere) è altresì la posizione non corretta della punta: quindi, una prevenzione efficace di tale complicanza è semplicemente il corretto posizionamento del catetere durante la procedura stessa, con verifica immediata della posizione della punta.
4) Accurata manipolazione della guida metallica.
Importante pratica per ridurre il rischio di aritmie. Il punto cruciale è l’inserzione della guida nel sistema venoso, a tal fine, è altamente raccomandabile utilizzare una guida metallica centimetrata.
5) Appropriata stabilizzazione del catetere nel caso dei cateteri esterni tunnellizzati cuffiati.
6) Confezione accurata della tasca del reservoir.
La scelta della sede ideale della tasca e la scelta delle dimensioni del reservoir dovranno tener conto sia delle problematiche di gestione del port (facilità di accesso con ago di Huber) sia delle esigenze estetiche-cosmetiche del paziente.
Inoltre, le dimensioni della tasca devono essere appropriate e minime in modo da garantire un’adeguata stabilità della camera nel sottocute, minimizzando i rischi di ribaltamento della stessa.
Infine, tra le problematiche potenzialmente negative associate all’impianto degli accessi venosi centrali a lungo termine, sono da annoverare non soltanto le complicanze cliniche a carico del paziente, ma anche una serie di problemi economici e logistici che conducono ad un anomalo rapporto costo-efficacia e ad una ridotta efficienza aziendale.
Ad esempio, una tecnica di impianto inappropriata o inadeguata può associarsi a una eccessiva durata della procedura, con ritardo nell’inizio del trattamento chemioterapico o del supporto nutrizionale, o a una più lunga degenza in ospedale prima della dimissione o a più lunghe liste di attesa.
La scelta di un ambiente inappropriatamente costoso (quale, ad esempio, la sala operatoria in situazioni ove l’impianto potrebbe avvenire in condizioni di sicurezza anche in un ambiente dedicato, come in day hospital) e lo spreco di materiale dovuto a reiterati fallimenti della venipuntura possono comportare un aumento eccessivo del costo economico della manovra.
Errori di tecnica (quale, ad esempio, una errata confezione della tasca) possono comportare la precoce perdita del sistema venoso e la necessità di riposizionarlo di nuovo. [15]
Inoltre, per un’ottimale prevenzione delle complicanze è fondamentale adottare tutte le misure necessarie per garantire la migliore gestione possibile del dispositivo.
È quindi fondamentale un’educazione di tutti gli operatori che andranno ad utilizzare il PICC-port, come personale medico, infermieristico e tecnico, in modo di metterli a conoscenza delle specifiche dei presidi in uso in ospedale, quali pressione massima tollerata e flusso massimo garantito.
Effettuare sempre un accesso asettico al PICC-port utilizzando le massime precauzioni di barriera (lavaggio delle mani, guanti sterili, asepsi cutanea). Utilizzare la corretta tecnica di inserimento dell’ago di Huber e della sua stabilizzazione con medicazione trasparente. Infine occorre anche provvedere ad una corretta educazione del paziente e del caregiver sul tipo di port che è stato impiantato e su lle sue caratteristiche, sottolineando la necessità di portare sempre con se il tesserino di identificazione del dispositivo, sui principi di manutenzione ordinaria compresa la frequenza dei lavaggi, sulla necessità della tecnica asettica durante il posizionamento dell’ago e di utilizzare solamente aghi non carotanti, ed infine di segnalare prontamente segni o sintomi di dolore, bruciore, prurito o dolenzia locale.
PRODOTTI CORRELATI
BIBLIOGRAFIA
- Piran, Siavash, et al. “Incidence and risk factors of symptomatic venous thromboembolism related to implanted ports in cancer patients.” Thrombosis research 133.1 (2014): 30 -33.
- Bertoglio, Sergio, et al. “PICC -PORT totally implantable vascular access device in breast cancer patients undergoing chemotherapy.” The Journal of Vascular Access (2019): 1129729819884482.
- Mori, Yukiko, et al. “A retrospective analysis on the utility and complications of upper arm ports in 433 cases at a single institute.” International journalof clinical oncology 21.3 (2016): 474-482.
- Fabio Conti, Enrico Cortesi, Baudolino Mussa, Rosario Spina, Lara Tollapi, Roberto Verna, “RECEPIMENTO ED APPLICABILITA’ SUL TERRITORIO ITALIANO DELLE PRINCIPALI LINEE GUIDA E RACCOMANDAZIONI INTERNAZIONALI SUGLI ACCESSI VENOSI.”
- Pittiruti, Mauro, and Giancarlo Scoppettuolo. “Manuale GAVeCeLT dei PICC e dei Midline: Indicazioni, impianto, gestione.” Elsevier Italia, 2016.
- Walser, Eric M. “Venous access ports: indications, implantation technique, follow-up, and complications.” Cardiova scular and interventional radiology 35.4 (2012): 751-764.
- Vescia, S., et al. “Management of venous port systems in oncology: a reviewof current evidence.” Annals of Oncology 19.1 (2008): 9 -15.
- Maki, Dennis G., Daniel M. Kluger, and Christopher J. Crnich. “The risk of bloodstream infection in adults with different intravascular devices: a systematic review of 200 published prospective studies.” Mayo Clinic Proceedings. Vol. 81. No. 9. Elsevier, 2006.
- O’Grady, Naomi P., et al. “Guidelines for the prevention of intravascular catheter-related infections. Centers for Disease Control and Prevention.” MMWR. Recommendations and reports: Morbidity and mortality weekly report. Recommendations and reports 51.RR -10 (2002): 1-29.
- Gallieni, Maurizio, Mauro Pittiruti, and Roberto Biffi. “Vascular access in oncology patients.” CA: a cancer journal for clinicians 58.6 (2008): 323 -346.
- Yildizeli, B., et al. “Complications and management of long -term central venous access catheters and p orts.” The journal of vascular access 5.4 (2004): 174-178.
- Dougherty, Lisa. Central venous access devices: care and management. Wiley-Blackwell, 2007.
- Dal Molin, Alberto, et al. “The late complications of totally implantable central venous access ports: th e results from an Italian multicenter prospective observation study.” European Journal of Oncology Nursing 15.5 (2011): 377-381.
- Merlicco, D., M. Lombardi, and M. C. Fino. “PICC -PORT: Valid indication to placement in patient with results of extensive skin burns of the neck and chest in oncology. The first case in the scientific literature.” International Journal of Surgery Case Reports 68 (2020): 63 -66. Pittiruti, Mauro, et al. “Il protocollo ISALT 2 per l’impianto degli accessi venosi centrali a lungo termine: una proposta GAVeCeLT per un approccio più sicuro e costo-efficace.” Osp Ital Chir 16 (2010): 359 -368.
- Association for Vascular Access (AVA). Position Statement on the Use of Real-Time Imaging Modalities for Placement of Central Venous Access Devices. 2008; www.avainfo.org.
- La Greca, Antonio. “TECNICA DI IMPIANTO DI ACCESSI VENOSI A BREVE, MEDIO E LUNGO TERMINE NEL MALATO ONCOLOGICO.” MANUALE PRATICO DI NUTRIZIONE PARENTERALE IN ONCOLOGIA: 81.
- Zimlichman, Eyal, et al. “Health care–associated infections: a meta -analysis of costs and financial impact on the US health care system.” JAMA internal medicine 173.22 (2013): 2039 -2046.
- Pittiruti, Mauro, et al. “The intracavitary ECG method for positioning the tip of central venous catheters: results of an Italian multicenter study.” The journal of vascular access 13.3 (2012): 357 -365.